2024年9月11日,金沙js4399首页生命学院、生命中心、免疫学研究所、膜生物学全国重点实验室的刘万里教授,与国内多位交叉学科合作者(西湖大学医学院陈相军研究员,华大生命科学研究院金鑫研究员,陆军军医大学邓国宏教授,北京大学黄岩谊教授,金沙js4399首页生命学院郗乔然研究员,复旦大学上海医学院陆路研究员)在免疫学顶级期刊《自然-免疫学》(Nature Immunology)发表研究论文“IGHG1变异体表现出极化分布并增强针对危险致病生物的IgG1抗体防护反应”(An IGHG1 variant exhibits polarized prevalence and confers enhanced IgG1 antibody responses against life-threatening organisms)。这项研究发现人类记忆性B细胞所主要使用的IgG1型抗原受体(IgG1-BCR)膜联重链的胞内信号转导区ITT-Tyr下游正五位的G396R变异体(rs117518546,IgG1-G396R)在东南亚中南半岛为主的周边地区人群呈现超高频分布,并能增强针对危险致命生物的IgG1型抗体防护反应。共整合分析现代人古代个体的遗传学数据和已经灭绝的古智人DNA数据,揭示该变异体最早出现在抗体编码基因组的人种(古智人和现代人)是五万年前的尼安德特古智人,且可能与2022年诺贝尔奖得主Svante Pääbo发现于欧洲巴尔干半岛的尼安德特古智人(Vindija个体)最直接相关。这一发现对于理解来自环境的选择压力如何在万年时空中塑造人群遗传结构,以及适应性免疫系统如何通过调控记忆性B细胞抗原受体IgG1-BCR的跨膜信号转导,来增强人类抵御病原体的免疫力,具有重要的生物医学意义。
环境中有害生物(包含各类病原体,毒蛇和毒蘑菇等动植物毒素)是人类进化中选择压力的主要来源。人类个体的基因多态性(genetic polymorphism,遗传变异)影响了不同个体对病原体感染的免疫力。理论上,环境中有害生物体的地理分布和攻击强度可以决定与免疫反应相关的遗传变异在全球不同人类族群中的保留与固定频率。作为适应性免疫力的启动器、放大器和记忆性免疫力的储存与提取模块,人类记忆性淋巴细胞的抗原受体复合物的遗传变异,极有可能在人类族群中展现出一定的保留和固定迹象。围绕这个极具挑战性和充满趣味性的科学问题,刘万里教授与国内外的合作者,以人类IgG1抗体重链编码基因IGHG1的一个单核苷酸级别的基因多态性(rs117518546,IgG1-G396R)为研究起点,开展了一系列由浅入深、交叉学科紧密结合的研究工作。IgG1-G396R影响IgG1型抗原受体膜联重链胞内信号转导区ITT-Tyr下游正五位的编码氨基酸(从不带电最小尺寸甘氨酸G,突变为带正电具有最大氨基酸侧链的精氨酸R)。刘万里团队此前的研究已证实IgG1-G396R为系统性红斑狼疮的新风险因子(Science 2018),也是结直肠癌的新保护因子(JCI 2022)。上述工作发表后,国内外多个研究团队陆续揭示IgG1-G396R在其他临床疾病中的差异性作用。因此,基于上述基础和临床医学相关研究,分析IgG1-G396R这一遗传多态性在人类种群中的分布和起源,并阐明其与疾病易感性及人类进化史的关系,是一个极具科学意义和价值的课题。
首先,项目联合研究团队分析全球不同大陆和次大陆现代人的超万人级别的大队列人群基因组数据(GnomAD和1000 Genomes),以及小队列但是包含142种稀少人类族群的西蒙斯基因组多样性计划数据库(Simons Genome Diversity Project)。让人意外的发现是,IgG1-G396R变异体在全球人口中出现显著两极化分布态势,其在非洲,欧洲,美洲(含北美洲,中美洲和南美洲)和大洋洲的主体人口中出现频率极低(minor allele frequency,MAF,仅为万分之几),但是在如下族群人口中频率较高:Bougainville population; Hawaiian population; Dusun population in Malaysia; Chinese Dai in Xishuangbanna; She population in China; Thai from Thailand; Kinh in Ho Chi Minh city, Vietnam; Southern Han Chinese, China; Chinese Han in Beijing, China; Bengali in Bangladesh。
形成鲜明对照且极为有趣的是,这些人群主体在地理位置上也展现了集中在东南亚中南半岛地区及其周边人群的趋势,但是IgG1-G396R在同为东亚国家的日本、韩国人群中比例明显低于上述人群,并且在巴布亚新几内亚和澳大利亚土著个体中并未出现,表明IgG1-G396R可能与某些种族人群以及特定区域的地理历史生物学的关键事件是紧密关联的(此类事件的本质还需要进一步交叉学科的深入研究)。通过对群体遗传学数据的分析发现IgG1-G396R在上述地区的人群中位于一个约300 kb的连锁不平衡(LD,Linkage disequilibrium)区块上,而且具有较高的固定指数(Fst);进一步的基因连锁分析发现在300 kb LD区块中IgG1-G396R位点所在的更为突出的190 kb LD区块进一步展现了较低的核苷酸多样性、Tajima D的负值,在选择性清除分析中展现了较高的被选择可能性,表明该位点(及周围区域)在进化上受到正选择压力(图1)。
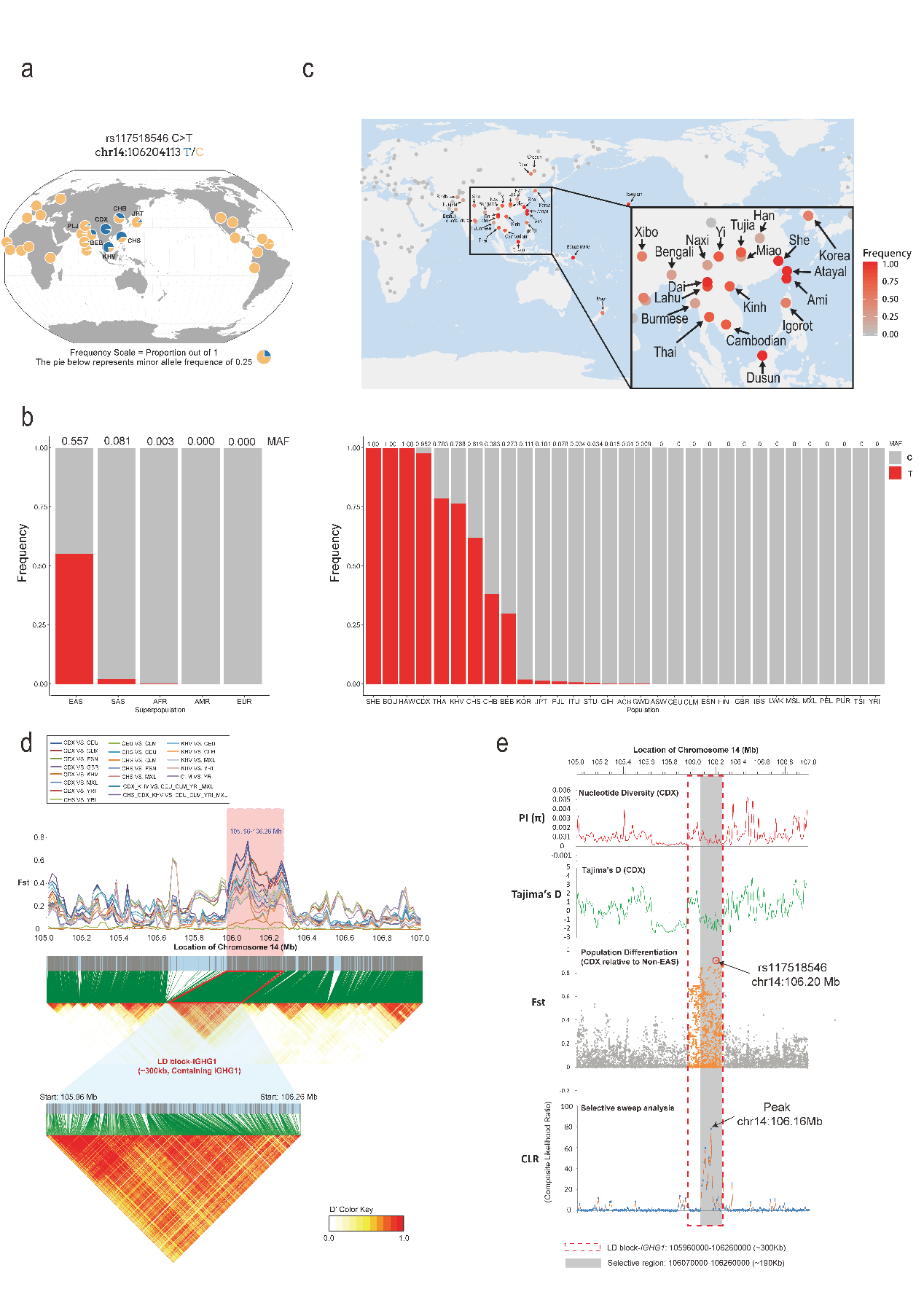
图1 IgG1-G396R变体在全球人群中的分布情况及其对IGHG1基因座的进化选择影响
为了进一步分析该变异体的起源,研究团队利用现代人类族群和古智人个体的基因数据,对190kb LD块的IGHG1区域进行主成分分析,发现其与Vindija和Chagyrskaya,这两个尼安德特古智人个体基因组的聚类最为接近。此外,与基因组上其他的随机190kb区段相比,尼安德特人的基因渐渗(genetic introgression)信号在该190 kb LD block-IGHG1区域尤为显著。通过比较古智人基因组和现代人类基因组中IGHG1基因座及其20kb侧翼区域的单倍型,发现Vindija 和Chagyrskaya尼安德特人与现今东南亚及附近地区人群的进化距离更近。有趣的是,具体到IgG1-G396R变异体位点本身,研究团队发现Chagyrskaya尼安德特人作为一个古智人个体并不携带IgG1-G396R变异体,而Vindija尼安德特古智人可能是IgG1-G396R变异体的杂合子携带者(此古智人个体,被2022年诺贝尔奖得主Svante Pääbo发现于欧洲巴尔干半岛克罗地亚的Vindija山洞,此个体也被其命名为Vindija尼安德特古智人);且从时间轴线尺度,Chagyrskaya尼安德特人出现也早于Vindija尼安德特古智人。更进一步,针对存在于Vindija尼安德特人基因组中,但在尼日利亚伊巴丹约鲁巴人中超过90%的个体不存在的基因变异(代表Vindija 尼安德特人基因组中特有的单倍型)进行更深入分析,也进一步揭示这种尼安德特人单倍型在现今东南亚及其相关附近地区人群中的频率最高发。最后,通过调查千人基因组中与G396R变异体紧密连锁的9个单核苷酸多态性位点(SNP),发现这9个SNP的分布与IgG1-G396R高度相似,而且这9个SNP均存在于 Vindija 和 Chagyrskaya 尼安德特人基因组中。这些古基因组分析和对东南亚主体人群和周边岛屿的土著人群的研究结果表明,IgG1-G396R变异体可能是在尼安德特人单倍型背景上富集,和/或出现在东南亚人群的祖先中(图2)。
为功能证明IgG1-G396R具有进化选择优势,研究团队在小鼠模型中实施肺炎链球菌,新冠病毒,沙门氏菌,银环蛇蛇毒(α-BGT)等多种低剂量免疫联合高剂量攻毒致死实验,发现IgG1-G396R能够通过增强抗体应答,提高机体对病原微生物及毒蛇毒素的抵抗作用。此外通过对中国深圳和武汉两个COVID-19病例队列以及相应的健康对照进行了基因型分析,研究团队发现IgG1-G396R与COVID-19的易感性存在显著相关性。利用PBMC RNA-seq数据,研究团队分析发现IgG1-G396R与多个B细胞活化相关基因的表达水平显著相关,提示该变异体可能通过调节免疫活化来影响机体免疫功能。进一步的蛋白质组学分析也验证了IgG1-G396R与多个免疫相关蛋白的丰度存在显著关联。在接种新冠疫苗的志愿者临床队列研究中,研究团队招募IgG1-396R的纯合携带者和IgG1-396G的纯合携带者,发现IgG1-396R的纯合携带者在接种新冠疫苗后产生的抗体水平和中和抗体效价明显更高,进一步证实这一变异对机体免疫功能的增强作用。在小鼠新冠感染实验中,研究人员构建了携带人ACE2转基因和人IgG1-G396R对应小鼠基因突变(IgG1-G390R)的基因敲入小鼠,发现hACE2和IgG1-G390R双基因修饰小鼠在SARS-CoV-2感染后表现出更强的免疫防御能力。
总上所述,研究团队的一系列交叉学科的研究结果揭示了宿主遗传变异作为疾病表型的影响因素的重要性,特别是在新发SARS-CoV-2传染病和其他人类历史上的感染事件中的潜在作用。这些发现为开发新的疫苗策略和治疗手段提供了新的生物学基础。此外,该研究还揭示环境中的复合型选择压力(含病毒,细菌类病原体,并叠加毒蛇毒蘑菇等动植物毒素),如何在几万年时空中综合包括历史、地理、生物在内的复合型事件因素,来塑造人群的适应性免疫分子的遗传结构提供了新的科学见解和新的研究范式。
金沙js4399首页生命学院、生命中心、免疫学研究所、膜生物学全国重点实验室刘万里教授是论文的首要通讯作者(lead corresponding author),西湖大学医学院陈相军研究员,华大生命科学研究院金鑫研究员,陆军军医大学邓国宏教授,北京大学黄岩谊教授,金沙js4399首页生命学院郗乔然研究员,复旦大学上海医学院陆路研究员是本文的共同通讯作者(co-corresponding author)。本研究的完成需要大力整合临床免疫学、基础免疫学、分子进化生物学、分子细胞生物学、古人类学、疫苗学、医学遗传学、传染病学等不同学科的交叉优势,因此本项目由国内外多家合作团队配合完成。金沙js4399首页孙文博博士,北京大学杨婷玉博士,重庆医科大学孙凤明博士,复旦大学徐巍博士,以及华大生命科学研究院刘盼红,蓝贤梅和金沙js4399首页高吉为论文共同第一作者。金沙js4399首页孙文博博士负责基础免疫学病原微生物攻毒及文章整理等工作,北京大学杨婷玉博士负责古人类分子进化分析工作,重庆医科大学孙凤明博士负责进化医学遗传学分析工作,华大生命科学研究院刘盼红、蓝贤梅负责新冠病人临床队列分析,金沙js4399首页高吉负责新冠患者测序数据库再分析,复旦大学徐巍博士负责hACE2和IgG1-G396R双基因修饰小鼠的P3级别攻毒实验等。在研究过程中,得到来自金沙js4399首页张林琦教授,张敬仁教授,韩国成均馆大学Han-Na Kim教授(负责提供并分析韩国新冠病人的万人级别大队列数据),中国科学院动物研究所翟巍巍研究员,华中科技大学程范军教授,深圳市第三人民医院王方教授,华大生命科学研究院朱焕焕,陆军军医大学谭文婷副研究员,北京大学庞玉宏副研究员,金沙js4399首页梁清泰博士,李翠峰博士,和刘晓航,陈浩泽,李桐博士研究生的大力支持。本研究团队还致谢金沙js4399首页王建斌研究员,娄智勇教授,向烨研究员,中国科学院古脊椎动物与人类演化研究所付巧妹研究员,复旦大学BSL-3实验室工作人员(蔡霞,胡高维,焦凡珂,邢立晓和闫妍),澳大利亚悉尼加文医学研究所Owen Siggs博士,荷兰Helen Pickersgill博士,以及泰国朱拉隆功大学、日本东京大学和理化研究所相关科研人员在科学问题讨论和实验材料方法方面的大力协助。研究团队得到了国家自然科学基金委杰青项目、重大研究计划、专项项目、重点项目,国家科技部重点研发计划,北京自然科学基金重点项目,深圳医学科学研究院临床专项项目,金沙js4399首页春风基金、金沙js4399首页生命科学中心、金沙js4399首页免疫学研究所、金沙js4399首页万科公卫学院的基金资助。
原文链接:https://doi.org/10.1038/s41590-024-01944-4