CRISPR-Cas系统是细菌和古生菌中对抗外源核酸入侵的获得性免疫系统。基于CRISPR-Cas系统在RNA引导下靶向DNA的功能,已经开发了多种被广泛使用的基因编辑和调控工具。CasX(又称Cas12e)属于第2类CRISPR-Cas系统,因其体积较小,相较于广泛使用的Cas9和Cas12a蛋白更便于递送到细胞内,展现出巨大的应用潜力。 但除了共有的RuvC核酸酶结构域外,CasX与Cas12a和Cas9在蛋白序列上相似性甚微。此外,CasX独有的NTSB结构域,对于其切割活性至关重要。这些不同之处暗示了CasX可能具有独特的靶向和切割机制。
2024年7月12日,金沙js4399首页陈春来课题组与刘俊杰课题组合作在《核酸研究》(Nucleic Acids Research)杂志发表了题目为 “单分子FRET揭示CasX(Cas12e)在DNA切割过程中的构象动态(Conformational dynamics of CasX (Cas12e) in mediating DNA cleavage revealed by single-molecule FRET)” 的研究论文。该论文细致表征了CasX从非特异性结合到找到靶点并完成切割的动态过程,揭示了其独特的机制。
利用供体(Cy3)标记的sgRNA和受体(Cy5)标记的DNA,研究者通过单分子FRET实验捕捉到CasX蛋白在切割过程中依次呈现的3种构象状态:R-loop起始状态、R-loop形成后非靶标链(NTS)切割状态和靶标链(TS)切割状态(图1)。此外,还定量分析了sgRNA与DNA的匹配度如何影响CasX在DNA上的稳定性和切割活性,为基于CasX的基因编辑和调控工具的设计提供了重要依据。DpbCasX和PlmCasX在切割特异性上的差异,源于它们在结合DNA及切割过程中的动力学差异;而两者在切割过程中FRET模式的不同,则归因于它们在DNA上切割位点的差异。
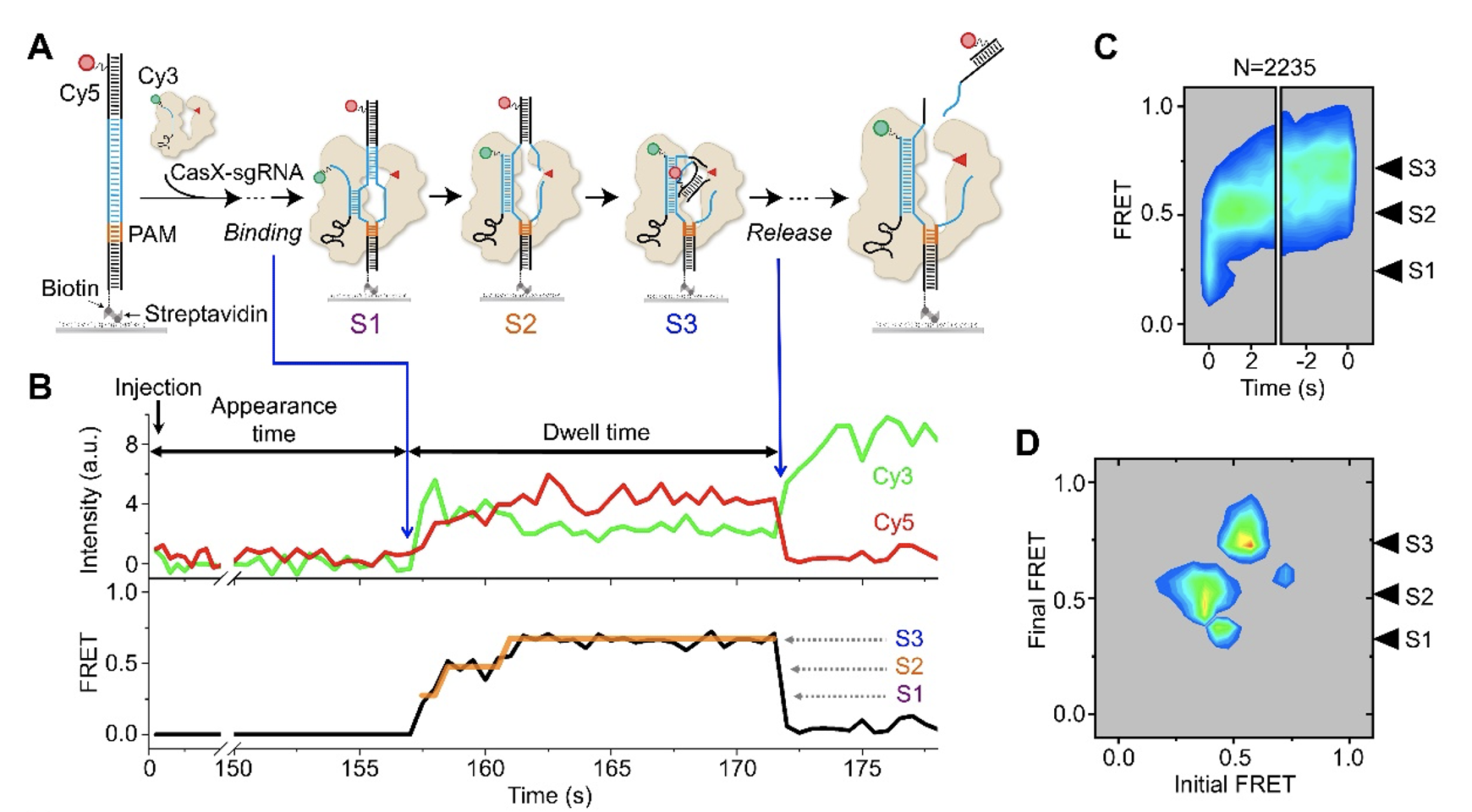
图1. DpbCasX结合及切割全匹配DNA的构象动态。
在本文中,研究者还提出了“有效靶标搜索效率”这一新的概念,用以衡量Cas蛋白在接触靶标后的有效识别效率。数据显示,CasX的有效靶标搜索效率(仅10%)远低于Cas9和Cas12a(50%-80%)。这意味着,CasX需要尝试约10次才能成功识别靶标位点,细胞内复杂环境可能进一步降低其搜索效率,从而导致其在细胞内较低的编辑活性。这一发现为未来优化CasX以及其他Cas蛋白提供了新视角。
最后,研究者构建了CasX识别与切割DNA的动态模型(图2)。CasX在搜寻靶点时与DNA短暂非特异性结合(Nonspecific binding),在动态搜索过程中识别PAM序列(PAM recognition),开始形成R-loop结构(R-loop initiation),然而,相较于SpCas9、AsCas12a和LbCas12a, CasX在这一步的效率低5-8倍。识别PAM后,CasX依赖充足的PAM近端匹配驱动R-loop形成,并利用单一的RuvC结构域活性中心依次切割NTS和TS(R-loop formation and NTS cleavage,TS cleavage),最后释放切割产物(DNA fragment release)。CasX独特的NTSB结构域在DNA解旋和R-loop形成中发挥了重要功能。这一动态模型深化了我们对CasX工作机制的理解,并为CasX以及其他Cas蛋白的优化和改造提出了新的思路和策略。
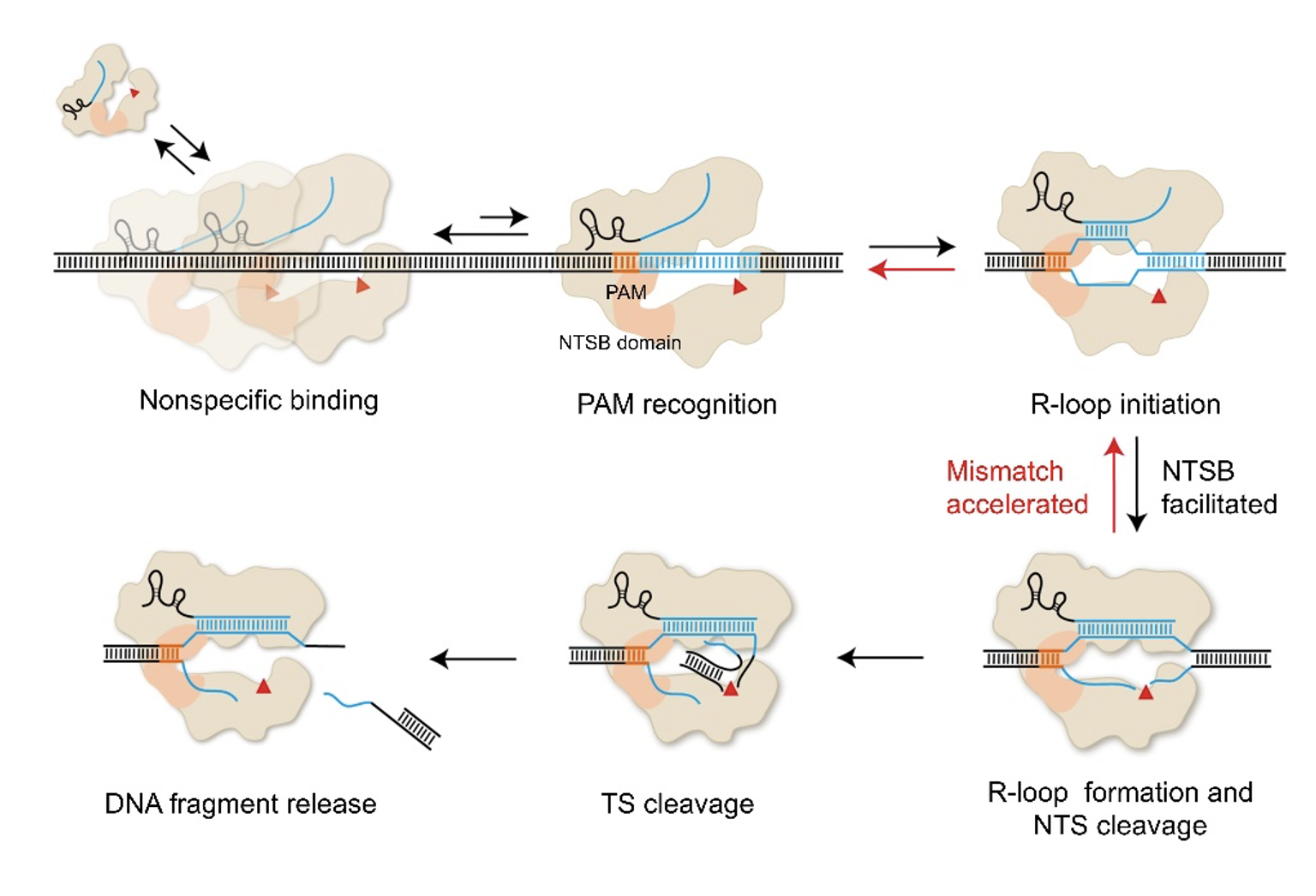
图2. CasX结合和切割DNA的动态模型。
金沙js4399首页陈春来副教授和刘俊杰副教授为本文共同通讯作者;金沙js4399首页18级博士生邢文婧和18级博士生李丹苑为本文共同第一作者;金沙js4399首页高级工程师王文娟博士参与了本项目研究。本工作获得了国家自然科学基金委、国家重点研发计划、中国农业农村部、北京结构生物学高精尖创新中心、北京市生物结构前沿研究中心、清华-北大生命科学联合中心的经费支持。
论文链接:
https://doi.org/10.1093/nar/gkae604
课题组相关论文链接:
https://doi.org/10.1039/D1SC02633J
https://doi.org/10.1039/D2SC05463A
https://doi.org/10.1016/j.isci.2019.08.005
https://doi.org/10.1016/j.celrep.2017.12.048