细胞的多能性(pluripotency)是指一种细胞可以分化为所有体细胞类型的潜能。在哺乳动物的早期发育过程中,具有全能性的胚胎在囊胚时期发生第一次细胞命运决定,形成内细胞团(ICM)和滋养层(TE)。其中内细胞团将产生整个胚胎谱系和未来的个体。多能性被认为首先出现在内细胞团中,并逐渐经历原始态(Naïve)、形成态(Formative) 和始发态(Primed) 的转变。先锋转录因子(pioneer transcription factors)例如OCT4和SOX2在多能性的调控中发挥至关重要的作用,被认为能够结合并主动打开封闭染色质,进而启动基因转录。Yamanaka等人通过表达转录因子OCT4,SOX2,KLF4和MYC可以将终末分化的体细胞重编程为诱导性多能干细胞 (iPSC)。然而,关于先锋因子如OCT4和SOX2如何调控多能性的研究前期主要基于体外培养的胚胎干细胞。这些因子在胚胎体内是如何调控多能性程序至今仍不清楚。
2023年12月15日,金沙js4399首页生命学院颉伟研究组在《科学》(Science)期刊上以长文形式发表了题为“早期胚胎多种SOX2 -增强子互作模式调控多能性程序”(Multifaceted SOX2-chromatin interaction underpins pluripotency progression in early embryos)的研究论文,报道了多能性先锋因子SOX2在哺乳动物早期胚胎多能性建立和转换过程中的调控机制。这一研究发现早期胚胎中SOX2与染色质并非简单通过先锋因子模式打开染色质启动基因表达,而是存在“Settler”,“Pioneer”和“Pilot”等多种与染色质互作模式。SOX2作为Pioneer主导建立的多能性调控网络在晚期囊胚才会开始出现。在该时期之前,早期囊胚中存在一种介于全能性和多能性之间的细胞状态,称为Pre-pluripotency。在Pre-pluripotency状态下,SOX2主要通过Settler binding而非主动打开染色质的方式介导基因表达,以完成与上游转录因子(NR5A2与TFAP2C)调控网络衔接,最终建立胚胎发育中时空特异的转录因子调控网络与细胞多能性状态。
通过优化CUT&RUN技术,研究者首先捕获了小鼠胚胎中多能性转录因子SOX2与染色质全基因组的结合位点,涵盖了从胚胎发育第3.5天 (E3.5)到第7.5天(E7.5)多能性细胞出现的全进程。利用Sox2基因敲除胚胎和胚胎干细胞,研究者系统探究了SOX2在多能性建立与转换过程中在对于基因表达和开启染色质的作用。实验结果显示,SOX2在早期胚胎发育过程中与染色质的互作并非呈现简单的先锋因子模式,而是表现出多种模式,包括“Settler binding”、“Pioneer binding”和“Pilot binding”。在E3.5 ICM中,SOX2主要结合已开放增强子(“Settler binding”)并促进ICM基因表达。这些预先开放的增强子部分由早期表达的转录因子TFAP2C和NR5A2介导打开。其中NR5A2为颉伟实验室近期鉴定的全能性胚胎核心调控因子(Lai et al., Cell Research, 2023)。同时,研究人员发现E3.5 ICM处于一个独特的“前多能性”(Pre-pluripotency)状态,介于全能性和多能性之间,在这个时期多能性调控网络还处在原始时期,多能性先锋因子尚未进入主导地位,但通过结合已开放染色质协助基因表达,以完成与上游发育程序的衔接。
随后,多能性细胞在E4.5天进入处于原始态多能性上胚层 (naïve epiblast),以及在E5.5天进入形成态多能性的上胚层(formative epiblast)。此时,SOX2在染色质发生了两次大规模的重新定位,打开沉默的染色质并启动基因表达,帮助启动naïve pluripotency和formative pluripotency程序(“Pioneer binding”)。另外,SOX2也可以结合在尚未开放的增强子上,并为其在进入下一个阶段的快速打开做准备(“Pilot binding”)。综上所述,这项研究工作揭示了早期胚胎发育过程中多能性程序的调控机制和先锋因子的工作机制,为更好地理解多能性和细胞命运的调控,以及体内体外多能性研究模型奠定了基础。
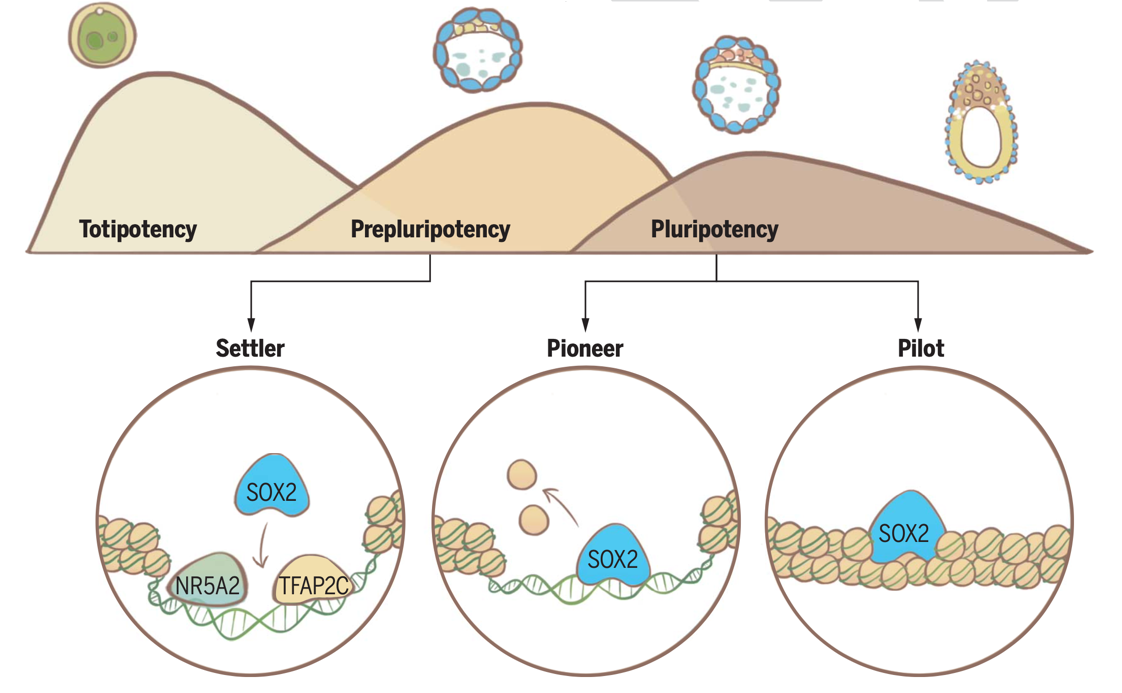
早期胚胎发育中SOX2通过多种先锋转录因子-增强子互作模式调控多能性程序
颉伟教授为本文的通讯作者,金沙js4399首页生命学院李丽佳博士(已毕业)、赖方秾博士(已毕业)、2019级博士生胡晓瑜以及博士后刘伯峰为共同第一作者。该课题得到了金沙js4399首页实验动物中心,生物医学测试中心基因测序平台以及计算平台的大力协助和支持。刘伯峰获得了金沙js4399首页水木学者计划支持,本研究获得了国家自然科学基金会、国家科技部重点研发计划、清华-北大生命科学中心的经费支持。颉伟教授是HHMI国际研究学者和新基石研究员。
原文链接:http://doi.org/10.1126/science.adi5516