
冷冻电子断层成像(cryo-ET)是在原位环境下发现并解析新结构,实现跨尺度生物成像的重要结构生物学手段。近年来cryo-ET领域蓬勃发展:一方面,cryo-ET数据采集及后续数据处理方法的技术革新带来了分辨率的革命性突破;另一方面,细胞环境下的目标识别技术及减薄冷冻细胞样品技术的发展,使在10万倍放大倍数下直接观察生理条件下细胞内的生物学过程成为可能。这两方面的革新相辅相成,极大地促进了在宿主细胞中原位高分辨观测病毒活动的研究新方向(图1),为病毒学研究、药物疫苗开发提供了宝贵的原位机制发现。
2023年5月10日,金沙js4399首页生命学院李赛团队在Annual Review of Biophysics发表题为《冷冻电子断层成像的分辨率革命及伴随涌现的原位病毒学发现》(Cryo-Electron Tomography: The Resolution Revolution and a Surge of In Situ Virological Discoveries)的综述文章。该文章系统总结了cryo-ET领域近年来的技术革新、分辨率突破及伴随其涌现的原位结构病毒学发现,并对该领域的未来研究进行了展望。
填补空白:cryo-ET填补传统生物显微技术的空白地带
每种生物成像技术都有各自擅长的观测尺度和对应的分辨率范围。在传统结构生物学技术数十纳米的观测尺度到光学显微成像技术数百纳米的分辨率之间存在着一个数量级的“空白地带”,而cryo-ET技术的观测尺度及分辨率刚好可以完美填补这一空缺(图1)。
Cryo-ET技术通过对样品多个角度拍照获得倾转系列(tilt series, TS),将其重构为三维断层图像,再使用子断层平均法(sub-tomogram averaging, STA)进行高分辨率结构解析。相比传统的冷冻电镜方法,cryo-ET技术有着优秀的层析能力,对样品纯度要求较低,无需使其脱离原生环境,能最大程度保留生物样品的自然状态。因此对于尺度在100纳米左右,结构形态均一性较差,且难以体外重组表达的囊膜病毒而言,cryo-ET可谓是极佳的研究方法。近5年来,cryo-ET迎来全面发展,层出不穷的技术革新在不断拓展其观测范围与分辨率极限,使不同尺度生物样品的原位观察更加流畅自然。
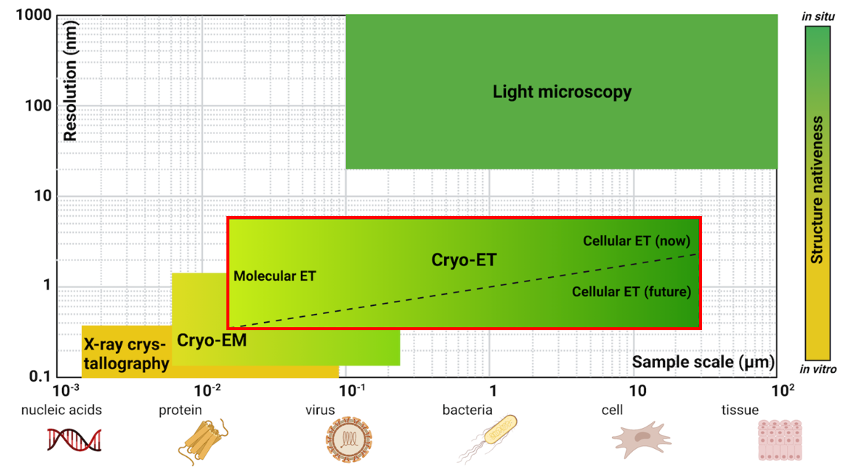
图1:Cryo-ET填补传统显微及结构生物学技术的空白地带(Sai Li; Trends in Biochemical Sciences, 2022; 47(2): 173-186)
Cryo-ET的分辨率革命:为原位观测大分子机器近原子分辨率结构打开崭新窗口
Cryo-ET面对的生物体系复杂,采集的数据规模庞大,处理起来环节繁多。因此,从制样到采集数据,再到结构解析,cryo-ET的工作流程存在多个影响分辨率的因素。这也成为制约cryo-ET分辨率突破的主要原因。本综述针对当前让人应接不暇的数据处理软件和流程进行了全面而细致的梳理:分别从前期的数据采集、预处理和后期结构计算三个方面,筛选出具有“里程碑”意义的突破性技术,并总结了“冷冻电镜分辨率革命”以来cryo-ET近十年的技术发展以及对应的分辨率突破(图2)。
在前期数据采集及处理方面,本文分别总结了最大程度保留数据高分辨信息的倾转系列采集方案,以及提高倾转系列采集通量的方法学探索历程,并梳理了针对倾转系列数据特点进行位移校正(motion correction)、衬度传递函数校正(CTF correction)、倾转系列对齐(tilt-series alignment)以及断层图像重构(tomogram reconstruction)在内的算法革新。后期结构计算方面,本文总结了利用人工智能辅助颗粒挑选的方法,及Relion 4,Warp & M,EMClarity等软件在颗粒对齐、分类、平均及循环纠正等步骤的算法创新。这些数据采集方案及处理算法的革新,逐步将cryo-ET的分辨率推进至如今的2-3埃,最终迎来了cryo-ET领域的分辨率革命,从而为原位观测大分子机器精细结构研究打开崭新窗口。
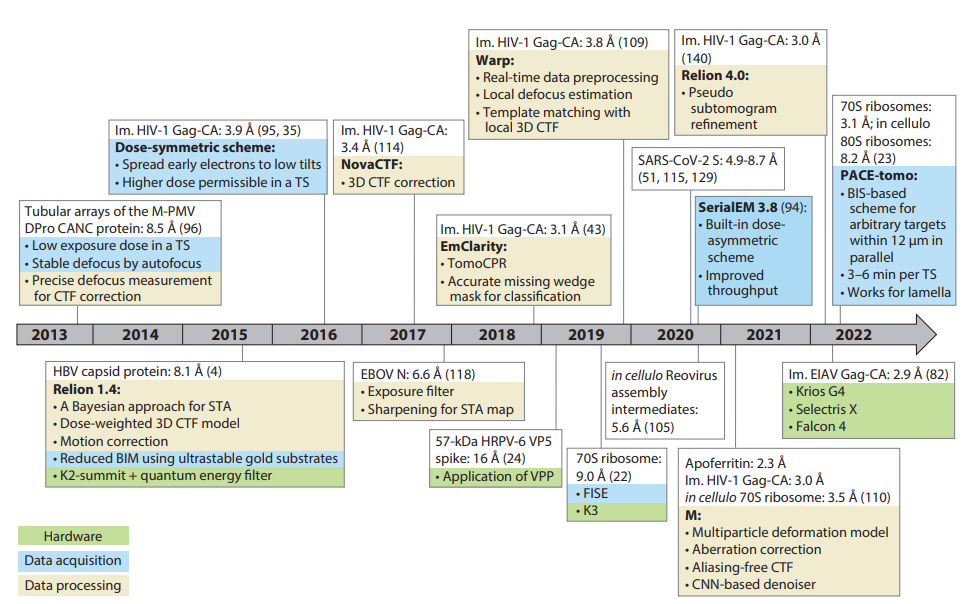
图2:“冷冻电镜分辨率革命”以来,cryo-ET近十年的分辨率发展。一系列重要的技术革新,推动了cryo-ET的分辨率革命
眼见为实:一系列原位结构生物学技术的发展,正将病毒生命周期的“示意图”转变为“结构现实”
全面了解病毒在宿主体内的生命周期是病毒学研究的重中之重,基于此我们才能从中发现漏洞,筛选靶点,有针对性地开发抗病毒药物及抗体。从一颗病毒入侵宿主细胞到大量子代病毒的释放,病毒在细胞内的行为千差万别,花样繁多。曾几何时,我们关于病毒“生命周期”的理解,主要来自于传统功能学实验、荧光显微镜及常温切片电镜观测。然而,随着快速投入式冷冻制样、高压冷冻制样、冷冻光电联合成像(cryo-CLEM)、电镜可见的特异性生物标记、冷冻聚焦离子束减薄(cryo-FIB milling)、相位板(VPP)、基于人工智能的图像识别、降噪和图形分割等一系列cryo-ET相关技术的发展,病毒生命周期的“示意图”正逐步转变为“结构现实”。
本文分别梳理了真核细胞及原核细胞内病毒的生命周期,并将其划分为三个阶段:第一阶段:病毒入侵宿主细胞,释放基因组;第二阶段:病毒诱导细胞内形成复制工厂并进行基因组的大量复制;第三阶段:子代病毒组装成型并脱离宿主细胞开启新一轮感染。同时,本文详细归纳了以上病理过程中的重要大分子结构,例如病毒复制工厂的孔道复合物、处于不同进程的病毒组装中间体以及正在向宿主递送基因组的噬菌体分子机器等。近五年来,此类研究成果快速涌现,大量不为人知、甚至曾被错误理解的病毒活动,终于得到眼见为实的证据(图3)。这些发现为药物靶点选择提供了有力的参考信息。
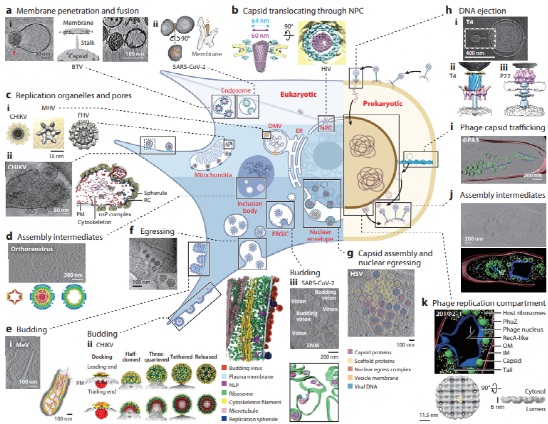
图3:通过揭示细胞内病毒活动的原位机制,cryo-ET正逐步将病毒生命周期的“示意图”转变为“结构现实”
分辨率革命只是开始:展望Cryo-ET的技术发展
本综述不仅对cryo-ET近十年来的技术革新和分辨率发展进行了细致的梳理,也归纳了cryo-ET揭示的病毒重要原位结构及入侵、复制机制。随着cryo-ET技术的的不断发展,它不仅为微生物领域带来大量新发现,也被广泛应用在神经生物学、细胞生物学、植物等领域。
然而,作为一门年轻的技术,cryo-ET领域仍有大量难题亟待解决。首先,相较于传统的冷冻电镜单颗粒分析技术,cryo-ET的工作流程整体更加复杂耗时且分辨率较低。本文指出开发可灵活组合使用的整合工具包将极大提升cryo-ET的工作效率。要提升子断层平均结构的分辨率需要从低信噪比数据中尽量完整有效地提取高频信息用于计算,这是cryo-ET结构计算领域的一大重要目标。此外,电镜图像虽能保留大量高频信息但其信噪比较低,常常难以锁定细胞内的目标分子。为此,联合其他显微手段,并通过开发新型样品特异性标记方式,可以帮助我们在细胞内寻找感兴趣的生物学事件。
金沙js4399首页生命学院/北京生物结构前沿研究中心/膜生物学国家重点实验室/清华-北大生命联合中心李赛副教授为本文通讯作者。金沙js4399首页生命学院2021级博士研究生洪烨、2018级博士研究生宋雨桐为本文共同第一作者。李赛课题组科研助理张哲源参与了本文工作。该研究受到国自然重点专项、面上项目,及金沙js4399首页春风基金重点项目的支持。
原文链接:
https://www.annualreviews.org/doi/abs/10.1146/annurev-biophys-092022-100958