CRISPR-Cas系统是原核生物的适应性免疫系统,它可以帮助细菌或古细菌抵御外源病毒的入侵,基于组分和功能可以划分成两大类。Cas12a属于第二大类的第五类型,可在crRNA的引导下找到PAM序列为TTTN的靶标位点,通过crRNA与靶标链的互补配对实现对靶标双链DNA的特异性结合,并利用RuvC亚基切割双链DNA产生黏性末端,接着通过体内的DNA修复途径完成DNA的插入和删除等,执行基因编辑的功能。此外,Cas12a也可以与功能蛋白相融合实现碱基编辑、转录调控以及受光或者化学小分子调控的基因编辑。对于所有的Cas蛋白和基于Cas蛋白的效应器来说,实现其功能的第一步是在基因组DNA链上众多的非特异性位点中找到正确的靶标位点。尽管有研究报道了AsCas12a利用三维和一维扩散的模式搜索靶点,但仍缺乏完善的结构基础和分子模型以阐释其靶标搜索这一动态过程。
2023年3月10日,金沙js4399首页陈春来课题组与刘俊杰课题组合作在《化学科学》(Chemical Science)杂志发表了题目为“Cas12a与PAM下游DNA位点的非特异性相互作介导靶标搜索过程并协助AsCas12a切割DNA。(Nonspecific interactions between Cas12a and dsDNA located downstream of the PAM mediate target search and assist AsCas12a for DNA cleavage)” 的研究论文。该论文揭示了在生理盐浓度下,Cas12a融合三维和一维扩散高效地搜索靶点,其REC2结构域中一段富含正电荷的a螺旋通过在搜索过程中与dsDNA的非特异性相互作用从而介导AsCas12a、LbCas12a和FnCas12a的一维扩散。此a螺旋也通过稳定DNA切割状态从而协助AsCas12a的靶标DNA的切割过程并影响AsCas12在体外和活细胞中靶标切割的特异性。这为优化和丰富多功能的CRISPR-Cas工具提供了一个新途径。
利用单分子荧光技术,该研究发现,不同种属来源的AsCas12a、LbCas12a和FnCas12a都采用围绕PAM位点的不对称一维扩散的方式找寻靶标位点(图1a),这与spCas9蛋白的靶标搜索现象非常类似(Chem. Sci., 2021,12, 12776-12784)。这表明除了PI(PAM-interacting)结构域,Cas12a还与PAM序列下游的DNA之间存在非特异性结合从而介导其不对称一维扩散。通过蛋白突变,该研究发现蛋白REC2结构域中一段富含正电荷的a螺旋(AsCas12a上的400-415位,LbCas12a上的380-391位和FnCas12a上的434-449位的氨基酸残基)介导蛋白的一维扩散(图1b)。破坏该螺旋与双链DNA之间的非特异性相互作用会显著地削弱一维扩散的贡献,缩短搜索长度,并使其表观靶标搜索速率降低10倍左右。另外,单分子FRET技术还揭示了AsCas12a上400-415位的a螺旋在DNA切割过程中还参与稳定非靶标链(NTS)以及靶标链(TS)的切割构象。将该区域内正电氨基酸残基突变为丙氨酸会降低DNA切割构象的稳定性,从而提高AsCas12a的切割特异性。而通过体外的DNA切割实验、体内的大肠杆菌以及HEK293T细胞的基因编辑实验均发现,调控AsCas12a以及SpCas9一维扩散的正电氨基酸的突变均可以提高蛋白DNA切割以及基因编辑的特异性(图1c)。
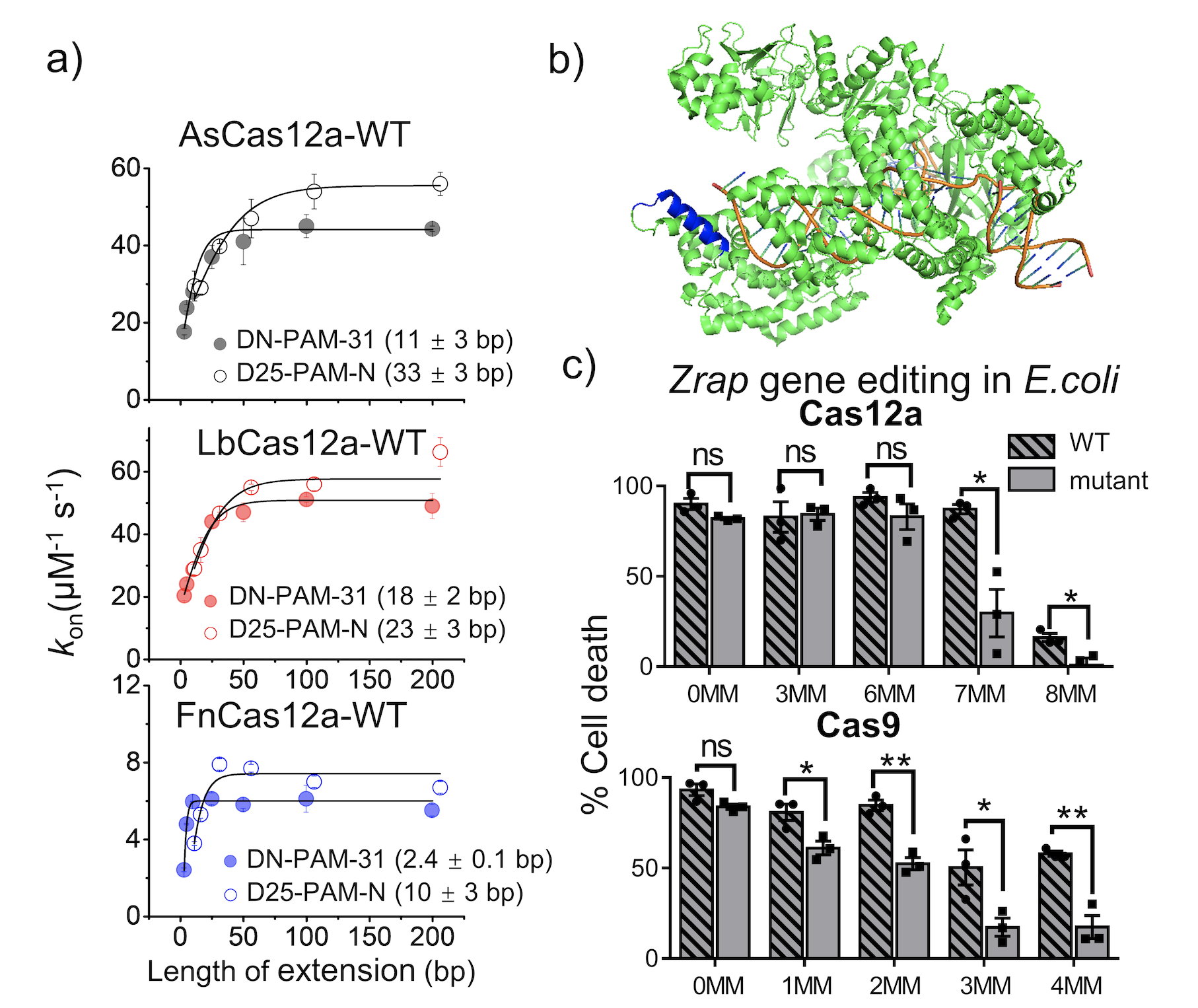
图1. Cas12a采用不对称一维扩散的方式找寻靶标位点,调控AsCas12a以及SpCas9一维扩散的正电氨基酸的突变均可以提高蛋白的切割特异性
最后,该研究提出了Cas12a搜索靶点的详细分子模型(图2):溶液中自由扩散的Cas12a/crRNA复合物通过三维随机碰撞与dsDNA相互作用,一旦REC2结构域中富含正电荷的a螺旋与dsDNA非特异性相互作用,Cas12a就会瞬时结合在DNA上并沿双螺旋进行短距离的一维扩散以寻找PAM位点。搜索到靶标位点后,PAM的识别会导致R-Loop的形成和延伸,从而进一步引发RuvC结构域对NTS和TS的顺序切割。而对于AsCas12a来说,非特异性结合位点除了介导一维扩散外,还起着稳定DNA切割构象的功能,从而促进DNA的切割并影响蛋白基因编辑的特异性。我们的工作为改造Cas蛋白的靶标搜索和切割过程均提供了可与现有策略相兼容的全新思路。
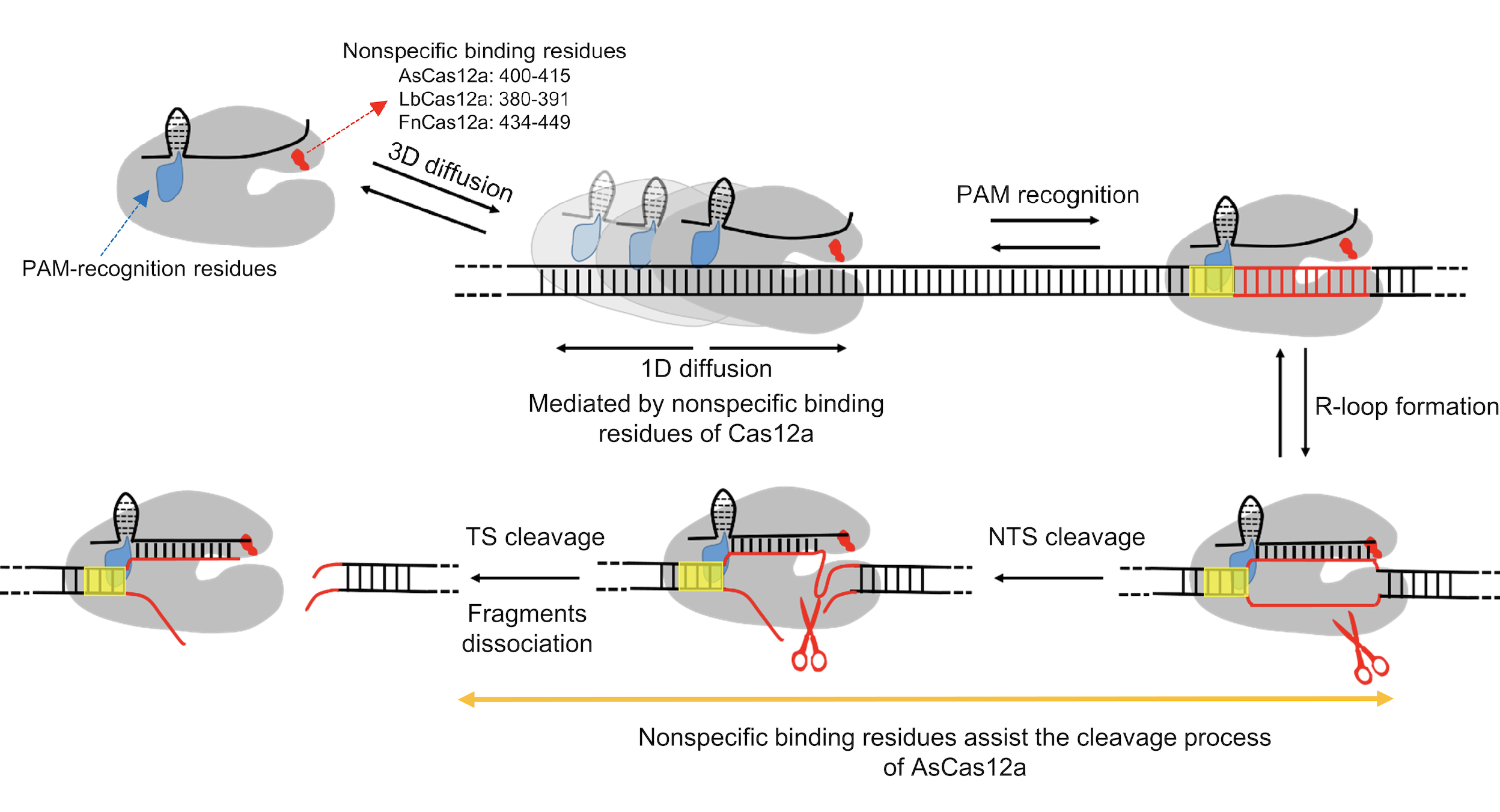
图2. 本文揭示的Cas12a靶标搜索和切割机制示意图
金沙js4399首页陈春来副教授为本文通讯作者;金沙js4399首页2017级博士生孙瑞瑞为本文第一作者;金沙js4399首页已出站博士后赵玉倩,高级工程师王文娟以及金沙js4399首页刘俊杰研究员均参与了本项目研究。本工作获得了北京结构生物学高精尖创新中心、北京市生物结构前沿研究中心、清华-北大生命科学联合中心及国家自然科学基金委的经费支持。
论文链接:
https://doi.org/10.1039/D2SC05463A
课题组相关论文链接:
https://doi.org/10.1039/D1SC02633J
https://doi.org/10.1016/j.isci.2019.08.005
https://doi.org/10.1016/j.celrep.2017.12.048