构成生命的天然核酸和天然蛋白质皆具有手性单一特性:已知的天然核酸皆由D型核糖组成,天然蛋白质几乎皆由L型氨基酸组成。朱听课题组致力于从遗传信息中心法则出发,利用化学、生物学等多学科手段构建与天然生物分子手性相反的“镜像生物学系统”。至今,该课题组已初步实现了镜像中心法则中的镜像核酸复制、转录、反转录等过程,突破了大型镜像蛋白质全化学合成和千碱基长度镜像基因合成的技术瓶颈,开发了镜像核酸测序、镜像DNA信息存储、镜像核酸定向进化等技术,目前正在着力构建镜像蛋白质翻译系统以实现完整的镜像中心法则,并尝试拓展镜像生物学系统的实际应用。
构建镜像蛋白质翻译系统的关键在于合成镜像核糖体。核糖体RNA是核糖体的结构与催化核心,其分子量约占核糖体总分子量的2/3,因此,合成镜像核糖体的难点在于制备长度分别约为120 nt、1.5 kb及2.9 kb的镜像5S、16S及23S核糖体RNA。然而受限于已有的技术,此前能获取的最长镜像RNA仅有120 nt,远不足以实现制备长链镜像RNA的目标。通过近六年的研究探索,朱听课题组全化学合成了分子量为100 kDa的高保真镜像T7 RNA聚合酶,并利用该镜像聚合酶转录出各种镜像RNA,包括镜像5S、16S及23S核糖体RNA、镜像核糖开关(riboswitch)、镜像核酶(ribozyme)等,且对多种镜像RNA展开稳定性研究。该研究成果以“利用镜像T7转录制备镜像核糖体RNA及功能性RNA”(Mirror-image T7 transcription of chirally inverted ribosomal and functional RNAs)为题,于2022年10月28日发表在Science杂志。
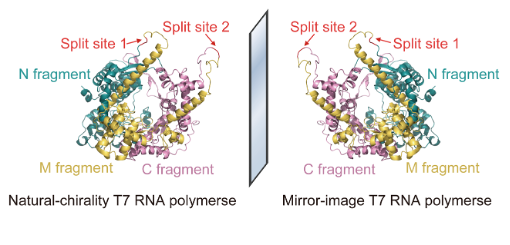
图1:合成镜像T7 RNA聚合酶
为突破全化学合成对蛋白质大小的限制,研究者利用分割蛋白质(split protein)的策略,将全长为883个氨基酸的T7 RNA聚合酶分割成长度分别为363、238和282个氨基酸的三个片段进行合成,并将其在体外共同复性,使其正确折叠成具有完整功能的100 kDa高保真镜像T7 RNA聚合酶(图1),为目前已报道最大的全化学合成镜像蛋白质。同时,研究者还利用该镜像聚合酶转录并纯化出全部三条镜像核糖体RNA,其中最长转录长度达2.9 kb(图2),为目前已报道最长的镜像RNA。该实验中使用的大型镜像蛋白质全化学合成策略和千碱基长度镜像基因的组装及转录技术,解决了长期制约镜像生物学领域发展的大型镜像生物分子的制备难题,为后续构建镜像蛋白质翻译系统、实现完整的镜像中心法则及拓展镜像生物学系统的实际应用奠定了基础。
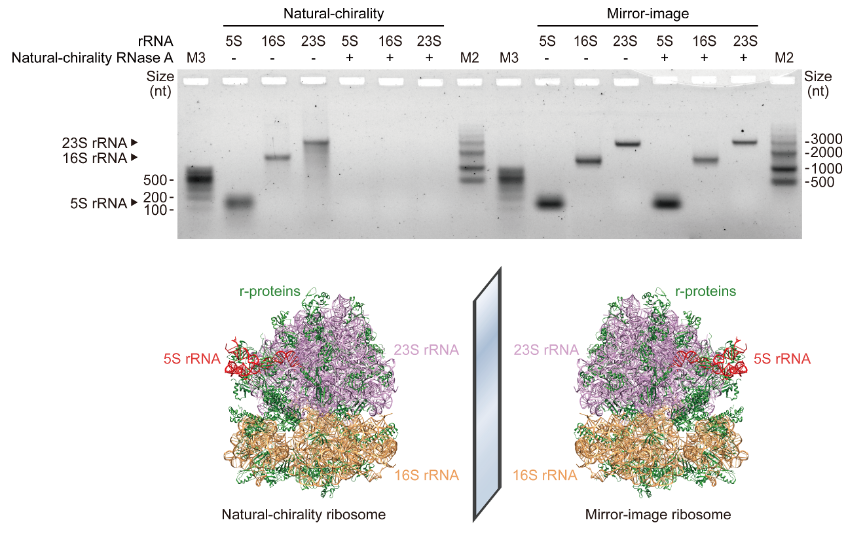
图2:转录并纯化镜像核糖体RNA
此外,研究者还尝试对镜像RNA展开稳定性研究(图3),将纯化后的长度为1.5 kb的天然及镜像16S核糖体RNA储存在经DEPC处理去除核糖核酸酶(RNase)的超纯水中,天然RNA在4小时后被完全降解;即使在样品中添加RNase抑制剂,其48小时后也被完全降解;而镜像RNA在30天后才被完全降解。该实验说明经DEPC处理的超纯水仍存在微量RNase污染,但镜像RNA独特的生物稳定性使其不受RNase污染的影响。研究者还将天然及镜像16S核糖体RNA储存在取自于自然环境的荷塘水中,结果显示,无论是否添加RNase抑制剂,天然RNA在4小时后均被完全降解,而镜像RNA在7天后才被完全降解。因镜像RNA具有独特的生物稳定性,未来有望成为一种不受RNase污染影响的RNA研究模式系统。
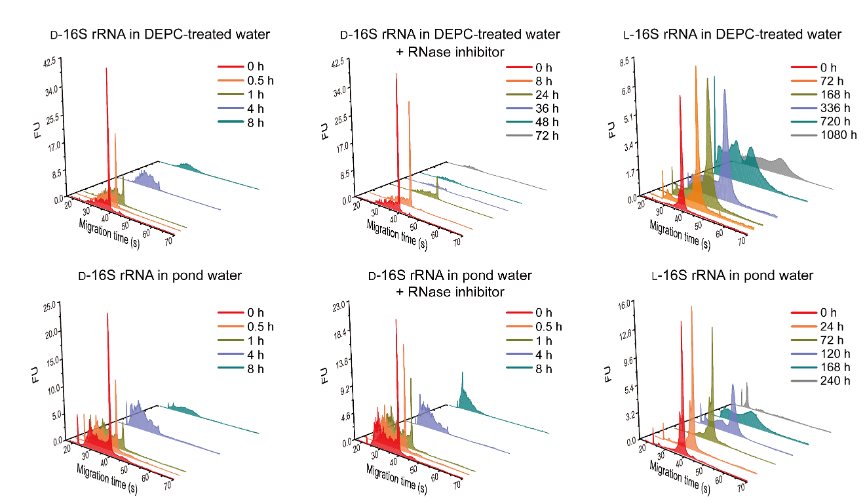
图3:研究镜像16S核糖体RNA的稳定性
综上,该研究报道了利用全化学合成的100 kDa高保真镜像T7 RNA聚合酶制备多种镜像RNA,包括镜像核糖体RNA及功能性RNA。该镜像T7转录系统有望被应用于诊断治疗、信息存储、分子计算、生物成像及RNA相关基础研究等领域。金沙js4399首页2017级博士生许媛为该论文第一作者,朱听教授为通讯作者。该研究获得了国家自然科学基金委、清华-北大生命科学联合中心及北京生物结构前沿研究中心的资助。
原文链接:https://www.science.org/doi/10.1126/science.abm0646
Science新闻链接:https://www.science.org/content/article/mirror-image-protein-factories-one-day-make-durable-drugs-body-cant-break
C&EN新闻链接:
https://cen.acs.org/biological-chemistry/synthetic-biology/Mirror-image-polymerase-makes-key/100/web/2022/10