2018年 11月15日,金沙js4399首页生命学院颉伟研究组和孟安明研究组紧密合作,在《分子细胞》期刊发表题为《亲本合子转换期广泛的增强子去记忆化和启动子预备化》(Widespread enhancer dememorization and promoter priming during parental-to-zygotic transition)的研究论文,揭示了斑马鱼亲本合子转换期表观基因组“擦除和重写”的转变模式。这一重要发现不仅有助于我们理解斑马鱼早期胚胎表观基因组多步骤建立的机制,也阐明了脊椎动物表观基因组重编程过程的保守性和物种差异性。
在动物个体发育过程中,表观基因组对时空特异的基因调控起到了十分重要的作用。表观遗传学的一个核心问题就是亲本的表观基因组能否遗传给下一代以及子代第一个表观基因组如何建立。前期小鼠和人类研究结果表明,很多亲本表观遗传信息在受精之后都被擦除,只有部分表观遗传信息会保留下来并发挥重要作用。然而,表观基因组重编程模式在不同物种之间是否保守,是否存在物种特异的显著差异是领域内一个非常重要的生物学的问题。斑马鱼作为常用的发育生物学模式生物,为研究上述两个问题提供了一个非常理想的平台。斑马鱼的早期发育过程与哺乳动物具有以下差异:首先,斑马鱼合子基因激活(ZGA,zygotic genome activation)发生较晚(在1000细胞期前后),能为研究早期胚胎发育中亲本-子代转换研究提供充足胚胎细胞和时间;其次,斑马鱼精子染色体不存在鱼精蛋白-组蛋白交换过程,其早期胚胎发育过程中也没有广泛的DNA去甲基化过程。为了开展这一研究,金沙js4399首页颉伟组利用其课题组研发的染色质免疫共沉淀技术(STAR ChIP-seq) (Zhang et al., Nature, 2016),实现了在少量细胞水平上进行组蛋白修饰的检测。进而与金沙js4399首页生命学院孟安明研究组紧密合作,并通过孟安明实验室最近发表的斑马鱼卵母细胞原位显微注射技术(OMIS,Oocyte Microinjection in situ)(Wu et al., JMCB, 2018),揭示了斑马鱼配子及早期胚胎发育过程中组蛋白修饰重编程的调控规律。
通过对斑马鱼配子及早期胚胎中的组蛋白修饰的研究,研究人员首先系统地检测了组蛋白修饰H3K4me3、H3K27ac、H3K27me3和H3K36me3在精子、卵子、4细胞时期、256细胞时期和穹顶期胚胎基因组内的分布特性。这些实验结果发现,亲本增强子区域的表观遗传学记忆会在受精前后快速的擦除。令研究人员惊讶的是,精子基因组增强子上的这种“去记忆化(dememorization)”甚至在受精之前就已经开始发生。卵子基因组的去记忆化则主要发生在受精之后。子代增强子的表观遗传标记则是在基因组激活前后(1000细胞)开始建立。与此不同的是,启动子区早在4细胞时期就会大量出现组蛋白乙酰化,提示启动子区域会进入一种提前预备的状态。一旦ZGA发生,这些提前预备的启动子将会被进一步修饰并进入启动或抑制程序。为了研究这种启动子提前乙酰化的可能功能,研究人员进行了母源敲低三个关键组蛋白乙酰转移酶。这种敲低导致了胚胎乙酰化的降低并引起基因组激活的异常以及胚胎死亡。进一步研究发现,这些启动子的预备和启动主要由母源因子调控。依据以上研究结果,研究人员提出了亲本合子转换期增强子去记忆化和启动子预备化的表观遗传学重编程模式。因此,这项工作揭示了不同脊椎动物物种亲本-子代转换中表观基因组重编程保守的“擦除-重建”的机制以及所采用的不同模式。
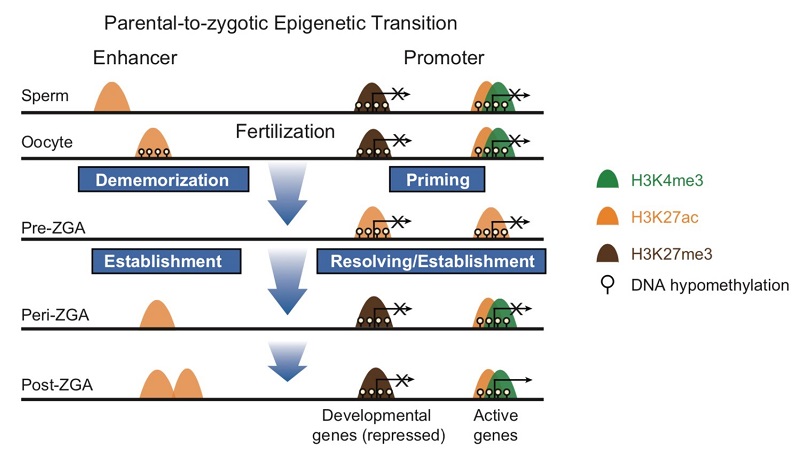
斑马鱼配子及早期胚胎合子基因组激活前后组蛋白修饰的调控模式
金沙js4399首页生命学院颉伟研究员和孟安明教授为本文通讯作者,金沙js4399首页生命学院博士生张冰洁,博士生吴小童,以及金沙js4399首页生命学院CLS项目博士生张文昊为本文共同第一作者。该课题得到了金沙js4399首页实验动物中心,生物医学测试中心基因测序平台以及计算平台的大力协助和支持。该研究获得了国家科技部重点研发计划、国家重点基础研究发展计划(973计划)、国家自然科学基金委优秀青年基金、国家自然科学基金委杰出青年基金、生命科学联合中心以及美国霍华德休斯医学研究所国际研究学者(HHMI International Research Scholar)的经费支持。
论文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(18)30877-3