当地时间2019年2月14日,颜宁研究组在《科学》(Science)背靠背在线发表了题目分别为《μ-芋螺毒素阻断人源电压门控钠离子通道Nav1.2的分子机理》(Molecular basis for pore blockade of human Na+ channel Nav1.2 by the μ-conotoxin KIIIA)和《人源电压门控钠离子通道Nav1.7与辅助亚基和动物毒素复合物的结构》(Structures of human Nav1.7 channel in complex with auxiliary subunits and animal toxins)的两篇研究长文,分别解析了人源电压门控钠离子通道(以下简称钠通道)Nav1.2与其特异性阻断毒素μ-芋螺毒素KIIIA复合物和人源钠通道Nav1.7与其特异性调节毒素ProTx-II或Huwentoxin-IV复合物的冷冻电镜结构,分辨率分别为3.0和3.2 埃(1埃=0.1纳米),为深入理解钠通道工作机理、疾病突变致病机理和特异性毒素与其相互作用机理提供了分子基础,同时为针对钠通道的多肽类药物研发提供了可靠模板。
钠通道负责动作电位的发生和传播,是所有可兴奋细胞(包括神经和肌肉细胞等)产生电信号的基本元件。在人体中,钠通道存在着九种亚型,命名为Nav1.1- Nav1.9。这些亚型的分布具有组织特异性,它们的异常失活和激活会导致严重的神经、心血管和肌肉等系统的多种疾病。其中,Nav1.2主要分布在大脑,其突变可导致癫痫、自闭症等疾病;而Nav1.7则主要分布在脊神经背根神经节、三叉神经节和交感神经节等处的疼痛感知神经元,与人体对疼痛的感知密切相关,其突变可以造成痛觉丧失或者极端疼痛等痛感异常相关的疾病。
早在2000年,世界卫生组织就提出“慢性疼痛是一类疾病”。疼痛严重影响人类的健康、工作和生活。疼痛可分为急性和慢性两种。其中,急性疼痛主要包括创伤和术后疼痛,而慢性疼痛则伴随多种类型的疾病,例如骨质疏松症、类风湿性关节炎、中风后疼痛、偏头痛、糖尿病性神经痛、脏器疼痛、腰背疼痛和癌痛等。据Decision Resources的报告指出,2013年全球主要医药市场的疼痛治疗费用达到365亿美元。值得一提的是,目前全世界面临着较为严重的阿片类止痛药成瘾危机。阿片类药物是治疗癌症疼痛等的主要止痛药,近年来被越来越多地滥用缓解慢性疼痛。但是使用阿片类药物止痛存在着较强的成瘾性和较为严重的呼吸抑制等副作用。以美国为例,仅在2017年,滥用阿片类止痛药致死人数已达到了6.4万。因此,国际制药界迫切希望能够开发出替代性的止痛药。
大量的遗传学工作表明Nav1.7与疼痛感知直接相关。Nav1.7的突变可以导致严重的家族遗传性疼痛异常或者痛觉丧失等疾病。因此以Nav1.7为靶标进行相关止痛药的开发是许多国际著名制药公司的重点研究方向。Nav1.7高分辨率结构的解析将极大地促进以其作为疼痛治疗靶点的药物研发。
因为钠通道在动作电位发生和传递中至关重要的作用,它们构成了包括蛇毒、蝎毒、河鲀毒素、蜘蛛毒素等在内的多种天然动物毒素的最主要作用靶点,而这些毒素也被作为可能的药物前体而被广泛研究。
由于分子量大,表达量极低以及结构本身的复杂性,人源钠通道一直以来都是结构生物学研究中最具挑战性的靶标之一。
在此次背靠背发表的两篇《科学》长文中,颜宁研究组利用冷冻电镜的方法,分别解析了人源钠通道Nav1.2和Nav1.7的高分辨率结构。
在Nav1.2的文章中,研究人员仔细分析了Nav1.2特异性毒素KIIIA与钠通道胞外区和离子选择筛的相互作用,并对已知结构的毒素与钠通道的相互作用类型进行了比较和归纳,从而揭示了其针对不同钠通道亚型具有特异性抑制的分子机理。这一发现为设计开发针对特定钠通道亚型的药物提供了分子基础和理论指导。
Nav1.7的文章有几个亮点:1. 作为重要的止痛药靶点,Nav1.7是最受关注的钠通道亚型,然而其重组蛋白表达困难限制了抗体制备和结构解析。在该研究中,研究人员通过筛选致病突变,仅仅通过引入一个氨基酸的点突变,就大大提高了蛋白的表达量,获得了适合结构解析的样品,这本身就对于未来的药物开发具有重要意义;2. 研究人员解析了Nav1.7在两个辅助亚基β1和β2并存的情况下,与两种改变通道门控特性的蜘蛛毒素分别结合的高分辨率冷冻电镜结构,揭示了这些毒素的结合位点,从而对钠通道受到毒素特异调节的机制进行了阐释和完善。
颜宁自2007年独立领导实验室以来,一直致力于钠通道的结构生物学研究,并取得了一系列重要成果:她们在2012年报道了一种海洋菌中的原核钠通道NavRh的晶体结构 (1);之后便集中力量攻坚真核钠通道的结构与机理,于2017年终于在世界上率先报道了第一个真核钠通道的原子模型,即来自美洲蟑螂的钠通道NavPaS的3.8埃分辨率电镜结构,揭开了钠通道的神秘面纱 (2);几个月后又报道了在钠通道研究史上占据重要地位的来自电鳗的钠通道EeNav1.4的电镜结构,并根据结构提出了钠通道快速失活的“变构阻碍”模型 (3)。在2018年,颜宁研究组在《科学》发表两篇背靠背长文,分别报道了NavPaS与经典神经毒素TTX/STX和一种门控调节毒素Dc1a的复合物结构(4),以及第一个人源的钠通道、骨骼肌特异的Nav1.4的高分辨率冷冻电镜结构(5)。本次报道的两项工作进一步巩固了颜宁研究组在钠离子通道结构生物学领域的领导地位,对于理解钠通道的工作机理、以及开展基于结构的药物开发具有重要意义。
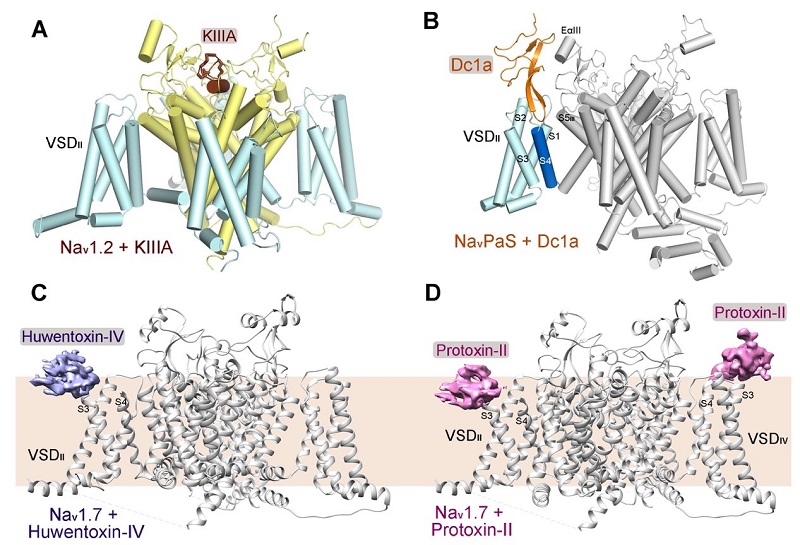
图1.钠通道和毒素相互作用的不同模式
(A)Nav1.2与特异性毒素KIIIA的复合物结构;(B)NavPaS与Dc1a的复合物结构;(C)Nav1.7与特异性毒素Huwentoxin-IV的复合物结构;(D)Nav1.7与特异性毒素ProTx-II的复合物结构。
原金沙js4399首页、结构生物学高精尖创新中心颜宁教授是两篇研究论文的通讯作者。
Nav1.2文章:金沙js4399首页医学院博士后、结构生物学高精尖创新中心卓越学者潘孝敬,生命科学联合中心博士生李张强、黄高兴宇,以及金沙js4399首页二年级博士生黄晓爽为共同第一作者。金沙js4399首页刘磊实验室进行了毒素的合成工作。
Nav1.7文章:金沙js4399首页医学院博士后、结构生物学高精尖创新中心卓越学者申怀宗和金沙js4399首页二年级博士生刘栋梁为共同第一作者,毕业于金沙js4399首页医学院、现就职于首都师范大学附属北京朝阳医院心脑肺复苏北京市重点实验室的吴坤博士进行了Nav1.7相关的电生理分析。
国家蛋白质科学中心(北京)金沙js4399首页冷冻电镜平台和金沙js4399首页高性能计算平台分别为该研究的数据收集和数据处理提供了支持,金沙js4399首页冷冻电镜平台的雷建林博士对数据收集进行了指导,并获得工作人员李晓敏博士的技术辅助。北京市结构生物学高精尖创新中心(清华)、生命科学联合中心(金沙js4399首页)、生物膜与膜生物工程国家重点实验室、科技部和基金委为该研究提供了经费支持。颜宁教授自2017年秋季入职普林斯顿大学分子生物学系后受到Shirley M. Tilghman讲席教授专项启动经费的支持。
原文链接:
Nav1.2: http://science.sciencemag.org/content/early/2019/02/13/science.aaw2999?rss=1
Nav1.7: http://science.sciencemag.org/content/early/2019/02/13/science.aaw2493?rss=1
相关论文链接:
1. X. Zhang et al., Crystal structure of an orthologue of the NaChBac voltage-gated sodium channel. Nature 486, 130-134 (2012).
2. H. Shen et al., Structure of a eukaryotic voltage-gated sodium channel at near-atomic resolution. Science 355, (2017).
3. Z. Yan et al., Structure of the Nav1.4-beta1 Complex from Electric Eel. Cell 170, 470-482 e411 (2017).
4. H. Shen et al., Structural basis for the modulation of voltage-gated sodium channels by animal toxins. Science, (2018).
5. X. Pan et al., Structure of the human voltage-gated sodium channel Nav1.4 in complex with beta1. Science, (2018).