2019年三月13日,金沙js4399首页生命学院陈柱成、李雪明课题组在《自然》(Nature)杂志上在线发表题为 《Snf2介导的染色质重塑中DNA滑移机理的研究》(Mechanism of DNA translocation underlying chromatin remodeling by Snf2)的研究论文。该工作解析了不同核苷酸状态下Snf2-核小体复合物的冷冻电镜结构,揭示了染色质重塑的机理。
SWI/SNF家族蛋白利用ATP水解产生的能量移动核小体在基因组DNA的位置,重塑染色质。这对于控制遗传物质的开放性,调节基因转录等方面发挥重要作用。陈柱成实验室近期报道了Snf2与核小体结合的结构 (Liu, Nature 2017)。但这个早期的工作并没有明确检测到DNA移位。 染色质重塑蛋白如何利用ATP水解的能量推动核小体滑移依然是一个让人困扰的难题。
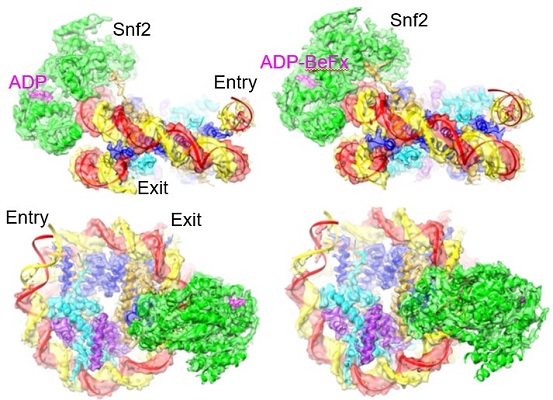
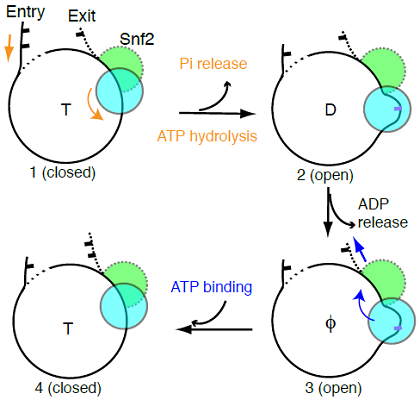
图1 Snf2-核小体复合物在不同核苷酸状态的整体结构以及核小体滑动模型
在这个研究基础上,陈柱成继续与李雪明实验室合作,利用冷冻电镜技术,进一步确定了在不同核苷酸(ADP和ADP-BeFx)状态下Snf2-核小体复合物的高分辨结构(图1)。他们发现在一个ATPase循环过程中,Snf2存在打开-闭合的构象变化。在打开状态下,Snf2在核小体结合点(SHL2)引起1bp DNA的凸起,这个形变沿DNA链向入口端传递,使得 1bp DNA被拉入核小体。而且DNA前导链比后随链有更明显的移动,显示DNA的“扭曲-滑移”运动。ADP-BeFx的结合导致酶构象闭合,核小体恢复到自然状态,没有明显的扭曲。Snf2介导的这种DNA运动模式超出一般想象。为了确认这些实验结果,陈柱成与中科院物理所李明实验室合作,利用单分子荧光技术(smFRET)确认了溶液状态的DNA运动与冷冻电镜结构一致。最后,研究者提出了染色质重塑的两步走”DNA波”模型:第一步,ATP水解,Snf2张开,把DNA从入口端拉进,并在SHL2处储存1bp DNA形变(“DNA波”);第二步,ATP结合,Snf2关闭,使得DNA形变向出口端传递,就像水波沿湖面传递一样,最终实现DNA对组蛋白的相对移动。这个模型表明Snf2水解一个ATP,移动1bp DNA。同时也解释了DNA移动的方向性机制。总之,本论文解答了染色质重塑过程中DNA移位的基本原理,相信此研究结果在染色质领域会有非常广泛的影响。

图2 研究团队。左起:陈柱成、李明、贾棋、李美静、田元元、李雪明、陆莹
金沙js4399首页生命学院陈柱成研究员、李雪明研究员以及中科院物理所李明研究员为本文共同通讯作者 (图2)。金沙js4399首页生博士生李美静,夏显,田元元和刘晓玉,以及中科院物理所博士生贾棋为本文共同第一作者。本课题由中国科技部,自然科学基金委提供经费支持,并得到清华-北大生命科学联合中心,北京市高精尖结构生物学中心的资助。
全文链接:https://www.nature.com/articles/s41586-019-1029-2