2019年8月6日,金沙js4399首页陈春来研究组在Cell期刊新推出的子刊《iScience》上发表了题为“crRNA和DNA的匹配度对Cas12a蛋白复合体切割双链DNA的动态结构和切割位点的调控”(Conformational dynamics and cleavage sites of Cas12a are modulated by complementarity between crRNA and DNA)的研究论文。该论文利用单分子荧光共振能量转移技术(single-molecule FRET)直接观测Cas12a复合体切割过程中动态构象变化,建立了相应的定量动力学模型,并揭示了crRNA和DNA的匹配度对复合体动态结构和切割位点调节机制。
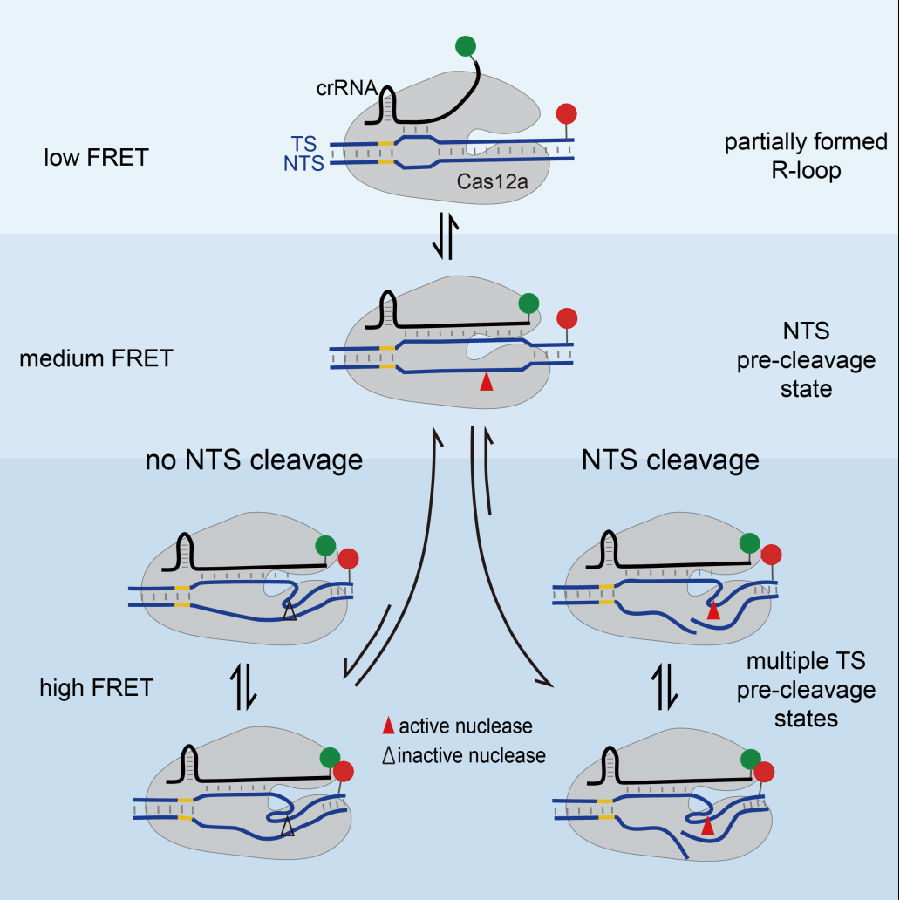
Cas12a蛋白(又称Cpf1)在哺乳动物的基因编辑中展现出了比Cas9蛋白更高的切割特异性。因此Cas12a切割双链DNA的分子机制受到了研究者的广泛关注。该研究利用单分子荧光共振能量转移技术,通过标记在crRNA和DNA上的荧光FRET对,来直接观测LbCas12a复合体在切割双链DNA过程中的动态构象变化,最终构建的定量动力学模型如图。首先,Cas12a/crRNA二元复合物识别靶标DNA序列,形成三元复合物,并在PAM序列近端开始形成R-loop(low FRET态)。随着R-loop的进一步延伸,Cas12a蛋白的核酸酶活性被激活,并且使得非互补链(NTS)从双链DNA结构解开,将切割位点暴露出来,以完成NTS链的切割(medium FRET态)。断裂的NTS链稳定了Cas12a复合体的互补链(TS)切割构象(high FRET态),以完成对TS链的切割。
通过以上模型,该研究揭示了Cas12a切割双链DNA过程中的重要分子机制。1)Cas12a结合和切割DNA过程中高度可逆的动态过程是导致其高特异性的重要因素之一;2)非互补链(NTS)从双链DNA上解开以暴露其切割位点这一过程,晚于Cas12a核酸酶活性的激活过程,是切割中重要的校验步骤;3)只有断裂的NTS链,才能稳定Cas12a复合体的互补链(TS)切割构象,从而确保了Cas12a利用单个结构域对两条DNA链有序的切割过程;4)Cas12a复合体存在多个互补链(TS)切割构象,可切割产生不同长度的产物,而切割构象的相对稳定性受到crRNA和DNA的匹配度的调控。
金沙js4399首页陈春来研究员为本文通讯作者。金沙js4399首页直博生张璐嘉为本文第一作者,孙瑞瑞、杨梦铱、彭思佳和程永新也为本工作做出了重要贡献。研究使用的LbCas12a表达质粒由哈尔滨工业大学生命学院黄志伟教授惠赠。该工作获得了国家自然科学基金委、清华-北大生命科学联合中心、北京结构生物学高精尖创新中心及北京生物结构前沿研究中心的经费支持。
论文链接:https://doi.org/10.1016/j.isci.2019.08.005
相关论文链接:https://doi.org/10.1016/j.celrep.2017.12.048