2019年7月18日,金沙js4399首页生命学院刘万里团队在科学杂志的综合子刊《科学进展》(Science Advances)发表题为“FcRL1内在性的招募c-Abl调控B淋巴细胞免疫活化与功能”(Fc receptor–like 1 intrinsically recruits c-Abl to enhance B cell activation and function)的研究论文。报道了FcRL1作为B淋巴细胞受体活化的共刺激分子内在性地增强B细胞免疫活化与功能的新型分子机制。
B细胞免疫活化的强度直接关系到后续B淋巴细胞的分化命运以及体液免疫应答效率,因此B细胞活化需要被精准调控。过去的研究中,一直认为CD19是B细胞激活过程中最为经典的活化型B细胞受体(BCR)辅助受体,参与BCR活化信号的上调以及后续的细胞增殖和分化调控。Fc receptor–like(FcRL)家族是新发现的表达在淋巴细胞表面膜联受体家族,其中Fc receptor–like 1(FcRL1)特异性表达在B细胞表面。虽然FcRL1分子的确切生理配体依然未知,但是其胞内结构域具有两个潜在的ITAM样序列,且已有文献报道针对FcRL1的抗体交联能够增强B细胞活化和增殖。因此,FcRL1研究领域,尚待解释的核心问题是,在FcRL1生理配体未知的情况下,如何阐述FcRL1的生理重要性,且解析FcRL1增强B细胞免疫活化和功能的分子机制。
本研究通过利用CRISPR/Cas9技术构建FcRL1缺失的模式细胞系以及小鼠动物模型,将高清高分辨率的全内反射荧光显微镜与传统的生物化学技术相结合,系统地研究了FcRL1参与调节B淋巴细胞活化和功能机制。研究发现FcRL1可以被BCR交联刺激强制性招募到B细胞免疫突触中(如图所示),发生寡聚化,从而触发FcRL1的胞内段Y281ENV基序中酪氨酸残基发生磷酸化,为含有SH2结构域的激酶c-Abl提供理想的附着位点(docking site),实现对c-Abl激酶分子的招募。FcRL1和c-Abl信号传导模块进一步有效地增强了B淋巴细胞的活化和增殖。FcRL1缺失并不影响B细胞发育,但是FcRL1缺失的小鼠表现出了T细胞依赖性与非依赖性抗原触发的抗体水平显著降低。研究发现小鼠在免疫后生发中心的形成和滤泡外浆细胞反应都因为FcRL1的缺失而被显著抑制。该研究系统地验证FcRL1作为活化型辅助受体以非配体依赖性模式参与到BCR信号转导调控中的机制,分析 FcRL1通路与 CD19通路之间的相似性与差异性,为开展以FcRL1为靶点的免疫治疗手段以及信号阻断药物研发提供了重要的理论基础。
刘万里研究员在加入金沙js4399首页生命学院、免疫学研究所、清华-北大生命科学联合以来,研究团队聚焦B淋巴细胞基础免疫学研究,整合交叉学科平台对B细胞免疫识别、免疫活化及相关免疫疾病的致病机理进行研究。自2011年回国独立工作以来,在B细胞异常活化与相关疾病(Science、J Exp Med、Leukemia两篇、Cell Research和eLife)、脂类代谢网络调控B细胞活化新机制(Cell、Science Immunology、Cell Reports和Nature Communications两篇)、受体复合物调控B细胞活化新机制(Science Advances、PNAS、eLife和Chemical Science)和机械力感知系统调控B细胞活化新机制(J Cell Biol、Science Signaling和eLife两篇)等方面有所建树。基于上述工作,多次受邀撰写综述(Trends ln Immunology、Advances in Immunology和Immunological Review等)。该论文的发表是刘万里研究团队对B淋巴细胞基础免疫学研究领域的新贡献。
金沙js4399首页生命学院刘万里研究员为本文共同通讯作者/最后责任作者,韩国成均馆大学医学院金兑振(Tae Jin Kim)教授,美国德克萨斯大学西南医学中心李全贞(Quan-Zhen Li)教授为本文共同通讯作者。金沙js4399首页生命学院博士研究生赵兴旺、硕士研究生谢恒义和PTN博士研究生赵萌为本文共同第一作者。本研究获得了国家自然科学基金委、生命中心和免疫所的大力支持。
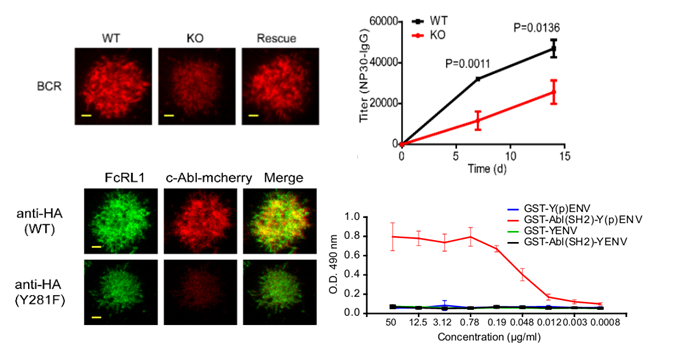
(BCR识别抗原后,FcRL1胞内Y281ENV基序招募c-Abl增强B细胞活化)