新型冠状病毒(SARS-CoV-2)对公共健康和社会经济发展造成了严重损失,其进化起源仍是一个谜。目前的研究结果提示,包括蝙蝠、穿山甲和水貂等在内的野生动物可能是新冠病毒的自然宿主,经过适应性和积累突变,新冠病毒可能通过其他动物宿主(中间宿主)最终传播到人,而我们对其跨物种传播途径和进化分子机制目前也知之甚少。冠状病毒表面的刺突蛋白(spike)在病毒进入宿主细胞过程中负责识别受体和介导膜融合,刺突蛋白在氨基酸序列和三维结构水平上的分子进化影响其对不同物种受体的识别,因而刺突蛋白是冠状病毒进化过程中的关键分子,其分子进化是冠状病毒实现跨物种传播的关键因素。
冠状病毒RaTG13从中国云南省中华菊头蝠中分离,是目前已知与新冠病毒基因组序列最接近的冠状病毒(序列一致性96.2%)。在广西壮族自治区和广东省查获的境外走私穿山甲样品中发现的多株冠状病毒(Pangolin coronavirus, PCoV),其基因组与新冠病毒基因组序列一致性也达到了85.5% -92.4%。2021年3月11日,金沙js4399首页王新泉教授课题组报道了RaTG13和PCoV_GX刺突蛋白的冷冻电镜结构。结构比较、序列比对和一系列生化和假病毒侵染实验结果,为深入理解新冠病毒通过刺突蛋白进化获得强感染力的分子机制提供了重要的结构信息。
此项研究之前,多个研究组报道了新冠病毒刺突蛋白的三维空间结构,其受体结合结构域(receptor-binding domain, RBD)存在 “up”和“down”两种构象,而只有呈现“up”构象的RBD才能够结合ACE2受体。王新泉研究组发现RaTG13和 PCoV_GX刺突蛋白结构中,其RBD只呈现出“down”的构象(图1a)。然而,进一步研究表明,PCoV_GX刺突蛋白与ACE2的结合能力与新冠病毒相当,且其假病毒也具有侵染细胞的能力;而RaTG13刺突蛋白与ACE2的结合能力和其假病毒侵染细胞能力都很弱(图1b)。通过定点突变、亲和力测定以及假病毒侵染实验,研究人员发现发现刺突蛋白RBD上第449位,501位和505位的氨基酸变化是导致RaTG13与新冠病毒在受体结合及假病毒侵染能力差异的重要位点(图1c)。RaTG13 刺突蛋白RBD上 D501N突变对其ACE2亲和力影响最大,结合能力提高了~9倍。值得注意的是,新冠病毒刺突蛋白RBD上同样位点的氨基酸变化(N501Y)在新冠病毒英国突变株B1.1.7、南非突变株B.1.351和巴西突变株P.1中均出现。通过对RaTG13和PCoV_GX刺突蛋白与ACE2复合物的负染电镜研究,研究人员还发现ACE2的出现能够诱导并稳定PCoV_GX刺突蛋白上RBD的“up”构象,而对RaTG13刺突蛋白则没有作用。以上研究共同提示,刺突蛋白RBD的灵活构象变化以及某些关键氨基酸位点的突变,对新冠病毒进化获得强受体结合以及细胞侵染能力至关重要。
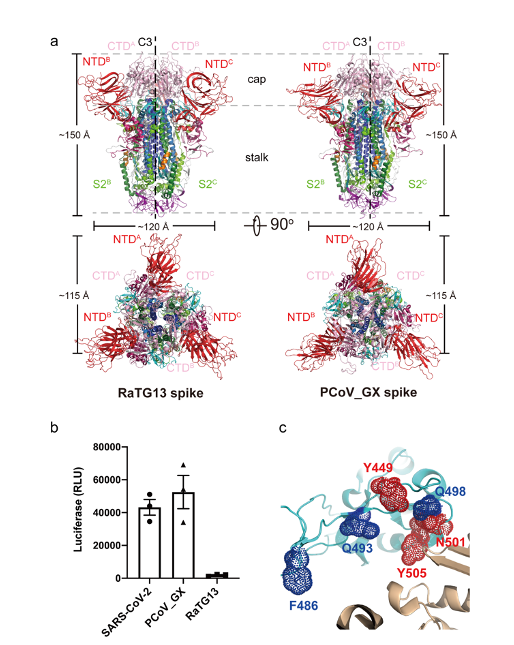
图1 a. RaTG13和PCoV_GX刺突蛋白三维结构;b. SARS-CoV-2, RaTG13和PCoV_GX假病毒入侵细胞的效率;c. SARS-CoV-2与RaTG13 RBD上导致与受体亲和力差异的重要氨基酸位点
该研究工作在《自然通讯》(Nature Communications)上发表,题为《蝙蝠和穿山甲冠状病毒刺突蛋白的结构为SARS-CoV-2的进化提供了线索》 (Bat and pangolin coronavirus spike glycoprotein structures provide insights into SARS-CoV-2 evolution)。金沙js4399首页王新泉教授为本文的通讯作者,王新泉教授课题组博士生张姝媛、谯淑元、余锦芳和曾建伟博士为主要工作完成者,医学院张林琦教授课题组博士生单思思完成假病毒侵染实验。电镜数据采集和计算工作在国家蛋白质科学研究(北京)设施的冷冻电镜平台和生物计算平台完成,质谱分析工作在代谢与脂质组学平台完成。本工作获得北京市结构生物学高精尖创新中心、北京市生物结构前沿研究中心、蛋白质科学教育部重点实验室、科技部重大科学研究计划专项、金沙js4399首页“春风基金”的大力支持。