2020年11月23日,PNAS以Latest Article的形式在线发表了由生命学院姚骏联合中国医学科学院许琪和美国索尔克研究所(Salk Institute)弗雷德•盖奇(Fred Gage)的课题组合作完成的题为”Syt7缺陷通过削弱GluN2B活性产生双相躁狂样行为异常”(Synaptotagmin-7 deficiency induces mania-like behavioral abnormalities through attenuating GluN2B activity)的研究论文,阐述了双相情感障碍(bipolar disorder, BD)躁狂情绪产生的机理研究进展。
课题组首先对BD的临床药理学资料进行了梳理。5-羟色胺(5-HT)重摄取抑制剂(SSRI)和GluN2B-NMDAR拮抗剂氯胺酮(ketamine)是两类代表性抗抑郁药物,然而它们具有截然不同的临床表现。SSRI类药对普通人没有情绪提升作用,对重性抑郁症患者有良好的疗效,但对于双相抑郁常常导致患者情绪由抑郁直接转入躁狂。SSRI刹不住车的现象提示:躁狂和抑郁可能不是通过单一通路的自身上下调节来实现的,而是分由不同体系主导,这些体系相互间攻守失衡导致或躁狂或抑郁;SSRI难以调和这种攻守平衡,从而导致情绪矫枉过正。进一步,ketamine类药物作为一类毒品,对普通人具有强烈的情绪亢奋作用,但是对双相抑郁却疗效温和,几乎不会产生矫枉过正的副作用。课题组据此推测,ketamine的靶点在BD病人体内存在较大程度的缺陷或失活,其直接后果是产生抗抑郁效应,推动躁狂的发生;在由抑郁体系主导的抑郁期,病人服用ketamine只能阻断残留靶点的活性,产生有限的抗抑郁反应,从而起到较好中和双相抑郁的作用。在这一推论下,姚骏课题组提出假说:ketamine的靶点GluN2B-NMDARs可能在病人体内存在较大程度失活,产生的抗抑郁效应可能是躁狂产生的主要原因之一。
课题组在前期工作中,发现Syt7所属的分子通路的缺陷很可能是BD发病和遗传的关键因素,Syt7敲除(KO)小鼠表现出躁狂抑郁交替的行为表型。在本研究中,课题组针对超过1400位BD患者和1200位健康对照进行测序研究,从病人中鉴定出多个Syt7基因突变,但是在健康对照中该基因无突变,证实了Syt7是BD的易感基因。进一步,在Syt7 KO小鼠中使用与ketamine具有相同机理的药物Ro25-6981进行治疗,发现Ro25-6981对野生型(WT)小鼠具有强烈的抗抑郁作用,但是对Syt7 KO鼠作用较为温和。这一结果直接证实了课题组在躁狂发生机理上的推测。
进一步,课题组以Syt7 KO小鼠神经元和BD病人iPSC分化神经元为模型,详细解析了Syt7与GluN2B-NMDAR之间的关系。课题组结合超高分辨率显微成像技术STORM和SIM、以及神经电生理技术,发现Syt7和GluN2B都位于突触的边缘活性区域(图一A),Syt7作为突触前的钙感受器所触发的神经递质释放能够特异、高效地激活突触后的位置相对的GluN2B-NMDARs;当Syt7缺失或发生功能障碍时,这一边缘区域的递质释放遭受阻碍,连带导致突触后GluN2B产生失活,从而发生抗抑郁效应,促使躁狂情绪发生(图一B)。本研究阐明了双相躁狂发生的机理,揭示了ketamine类药物对双相抑郁具有理想疗效的原因,论证了针对NMDAR进行药物研发可能是治疗双相障碍的较佳途径。
金沙js4399首页生命学院姚骏研究员和中国医学科学院许琪研究员、美国索尔克研究所(Salk Institute)的弗雷德•盖奇(Fred Gage)教授为本文共同通讯作者。生命学院博士后王秋文、博士生卢思瑶和刘要南为本文共同第一作者。军事医学科学院沈伟博士、中国医学科学院韦晖博士、金沙js4399首页生命学院代安邦博士、首都医科大学北京朝阳医院黄轩博士、姚骏课题组博士生陈运、付崇雷、王颖菡、以及博士后陈艳芬等为本项研究工作做出了重要贡献。本研究获得了膜生物学国家重点实验室、科技部重点研发专项、国家自然科学基金和清华-北大生命科学联合中心的经费支持。
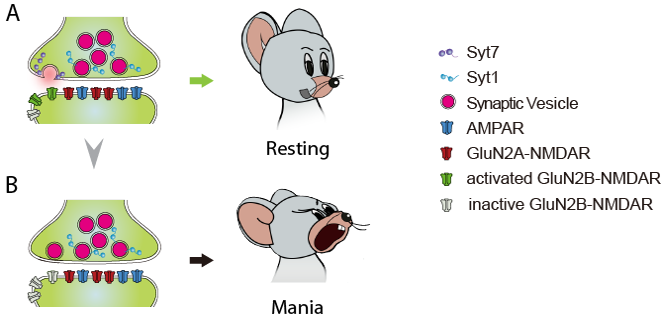
图一. Syt7缺陷导致双相躁狂的发生机理
原文链接: https://doi.org/10.1073/pnas.2016416117