2020年8月12日,金沙js4399首页杨茂君教授课题组与中科院上海药物研究所李扬研究员课题组以及同济大学附属第一妇婴保健院刘志强教授课题组合作在《科学进展》(Science Advances)杂志在线发表了题为 “人源CLC-7/Ostm1转运体的结构与分子机理 (Molecular insights into the human CLC-7/Ostm1 transporter)” 的研究论文。该研究首次解析CLC家族蛋白与辅助亚基的复合物结构,并且通过结构分析和电生理试验,详尽阐明了CLC-7/Ostm1复合物的门控机制,研究结论将为骨硬化病临床治疗策略的研发提供新的思路。
骨硬化病是一种具有家族遗传倾向的罕见病,临床症状包含骨硬度增加,骨骼生长异常,严重患者可表现小颌畸形、脑积水、颅神经压迫、额部隆起、眼突出、后鼻孔狭窄等,针对该类疾病尚无良好的防治手段。临床研究表明目前至少有八种基因突变能够导致骨硬化病。其中CLC-7蛋白属于氯离子转运相关的CLC家族蛋白,CLC-7蛋白主要分布在溶酶体和破骨细胞褶皱膜上,Ostm1可以作为CLC-7的辅助蛋白来维持骨重吸收和溶酶体生理功能。目前研究表明,人源CLCN7和Ostm1的基因突变能够导致严重的骨硬化疾病和溶酶体贮积紊乱疾病。虽然目前已经报道解析了大肠杆菌和红藻的CLC转运体蛋白,但对于人源的CLC-7/Ostm1蛋白复合物的结构仍然未知。因此阐述CLC-7/Ostm1蛋白质的三维结构以及生理功能对骨硬化病的治疗具有指导意义。
研究团队使用哺乳动物细胞系统表达纯化了CLC-7/Ostm1的复合物,并通过冷冻电镜第一次解析了CLC-7与辅助亚基Ostm1的复合物结构。CLC-7/Ostm1复合物结构显示高度糖基化的Ostm1在空间上像 “帽子” 一样位于CLC-7上方,并与CLC-7形成相互作用,
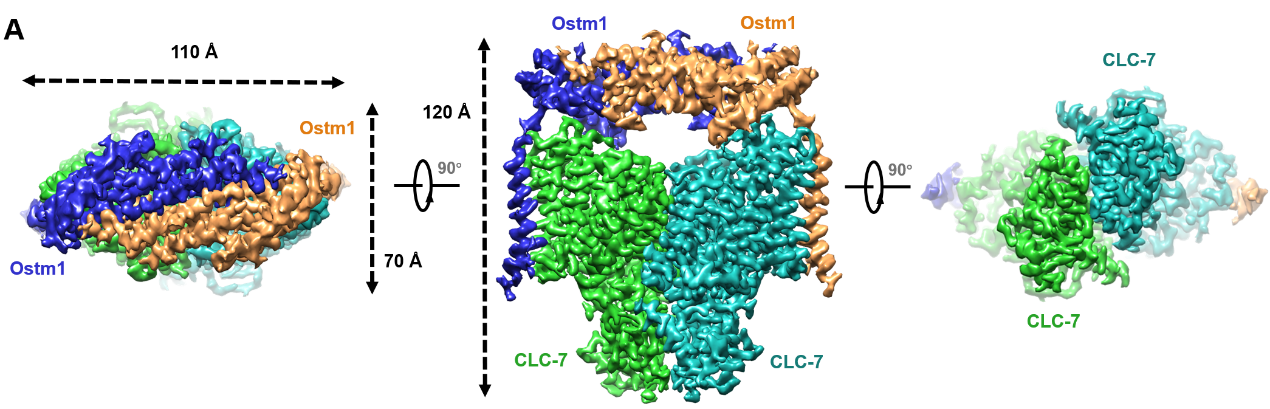
图示: CLC-7/Ostm1的三维结构展示
通过结构分析发现CLC-7中N端结构域与其他已解析的CLC蛋白N端结构不同;CLC-7的N端结构域插入到CLC-7的跨膜区和胞内结构域接触面缝隙中,并与跨膜区和胞内区形成相互作用。同时,结合基因突变(点突变)和电生理实验发现CLC-7结构域接触面(跨膜区与跨膜区接触面,跨膜区与胞内区接触面,以及N端结构域与跨膜区和胞内区接触面)多个位点突变均可导致CLC-7/Ostm1复合物 “慢门控” 特征发生变化。结构分析和电生理试验表明CLC-7结构域接触面的相互作用是影响CLC-7/Ostm1复合物 “慢门控” 的关键因素。
金沙js4399首页生命学院杨茂君教授、中科院上海药物所李扬研究员和同济大学附属第一妇婴保健院刘志强教授为本文共同通讯作者,金沙js4399首页生命学院博士后张森森,博士生刘洋,周俊以及同济大学附属第一妇婴保健院副研究员张兵为本文共同第一作者,中科院上海药物所博士生李天宇帮助了电生理实验。本研究受到了国家重点研发项目,中科院战略重点研究项目基金以及国家自然科学基金的支持。
论文链接:https://advances.sciencemag.org/content/6/33/eabb4747